Tóm tắt và giải hóa lớp 9 bài 5 – Luyện tập: Tính chất hóa học của oxit và axit
Tóm tắt và giải hóa lớp 9 bài 5 – Luyện tập: Tính chất hóa học của oxit và axit
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 9 bài 5 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 9 bài 5 :
- Tính chất hóa học của oxit :
– Oxit bazơ tác dụng với nước tạo thành dung dịch bazơ (kiềm), tác dụng với axit tạo thành muối và nước, tác dụng với oxit axit tạo thành muối.
– Oxit axit tác dụng với nước tạo thành dung dịch axit, tác dụng với dung dịch bazơ tạo thành muối và nước, tác dụng với oxit bazơ tạo thành muối.
Phân loại : Dựa vào tính chất hóa học của oxit, người ta phân loại oxit thành 4 loại :
– Oxit bazơ là những oxit tác dụng với dung dịch axit tạo thành muối và nước.
– Oxit axit là những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
– Oxit lưỡng tính là những oxit tác dụng với dung dịch axit và tác dụng với dung dịch bazơ tạo thành muối và nước.
– Oxit trung tính hay còn gọi là oxit không tạo muối là những oxit không tác dụng với axit, bazơ, nước.
- Tính chất hóa học của axit :
– Dung dịch axit tác dụng được với một số kim loại tạo thành muối và giải phóng khí hiđro.
Những kim loại không tác dụng với HCl, H2SO4 loãng như Cu, Ag, Hg,…
Chú ý: Axit HNO3 và H2SO4 đặc tác dụng được với nhiều kim loại nhưng không giải phóng hiđro.
– Axit tác dụng với bazơ tạo thành muối và nước.
Phản ứng của axit với bazơ là phản ứng bão hòa.
– Axit tác dụng với oxit bazơ tạo thành muối và nước.
– Ngoài ra, axit còn tác dụng với muối.
Phân loại : Dựa vào tính chất hóa học, axit được phân thành 2 loại :
– Axit mạnh
– Axit yếu
2. Hướng dẫn giải bài tập Hóa học 9 bài 5 :
Bài 1 trang 21
Có những oxit sau : SO2, CuO, Na2O, CO2. Hãy cho biết những oxit nào tác dụng được với
a) Nước
b) Axit clohiđric
c) Natri hiđroxit
Viết các phương trình hóa học.
Bài giải :
a) Những oxit tác dụng với nước: SO2, Na2O, CO2
SO2 + H2O → H2SO3
Na2O + H2O → 2NaOH
CO2 + H2O → H2CO3
b) Những oxit tác dụng với dung dịch HCl: CuO, Na2O
CuO + 2HCl → CuCl2 + H2O
Na2O + 2HCl → 2NaCl + H2O
c) Những oxit tác dụng với dung dịch NaOH: CO2, SO2
Na2O + CO2 → Na2CO3
Na2O + SO2 → Na2SO3
Bài 2 trang 21
Na2O + CO2 → Na2CO3 Những oxit nào dưới đây có thể điều chế bằng
a) phản ứng hóa hợp ? Viết phương trình hóa học
b) phản ứng hóa hợp và phản ứng phân hủy ? viết phương trình hóa học.
(1) H2O; (2) CuO; (3) Na2O; (4) CO2; (5) P2O5
Bài giải :
a) Cả 5 oxit đã cho có thể điều chế bằng phản ứng hóa hợp.
2H2 + O2 2H2O
2Cu + O2 2CuO
4Na + O2 2Na2O
C + O2 CO2
5O2 + 4P 2P2O5
b) Các oxit có thể điều chế bằng phản ứng hóa hợp và phản ứng phân hủy là: CuO, CO2, Na2O, H2O
Cu(OH)2 CuO + CO2
2Cu + O2 2CuO
CaCO3 CaO + CO2
2Ca + O2 2CaO
4NaNO2 2N2 + 2Na2O + 3O2
4Na + O2 2Na2O
2NaHCO3 H2O + Na2CO3 + CO2
2H2 + O2 2H2O
Bài 3 trang 21
Khí CO được dùng làm chất đốt trong công nghiệp, có lẫn tạp chất là các khí CO2 và SO2. Làm thế nào có thể loại bỏ những tạp chất ra khỏi CO bằng hóa chất rẻ tiền nhất ? Viết các phương trình hóa học xảy ra.
Bài giải :
Để loại bỏ SO2 và CO2 ta dùng dung dịch bazơ. Dung dịch bazơ rẻ tiền nhất là dung dịch nước vôi trong Ca(OH)2. Dẫn hỗn hợp khí đi qua dung dịch Ca(OH)2 dư, toàn bộ SO2 và CO2 sẽ bị hấp thụ. Khí CO không phản ứng, thoát ra và được thu lấy.
Phương trình hóa học :
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
Bài 4 trang 21
Cần phải điều chế một lượng muối đồng (II) sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric ?
a) Axit sunfuric tác dụng với đồng (II) oxit
b) Axit sunfuric đặc tác dụng với kim loại đồng.
Giải thích các câu trả lời.
Bài giải :
Phương trình hóa học :
CuO + H2SO4 → CuSO4 + H2O (1)
Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O (2)
Ta thấy:
PTHH (1) : để sản xuất ra 1 mol CuSO4 phản ứng (1) cần 1 mol H2SO4.
PTHH (2) : để sản xuất ra 1 mol CuSO4 phản ứng (2) cần 2 mol H2SO4.
Do đó phản ứng (1) tiết kiệm H2SO4 hơn.
Bài 5 trang 21
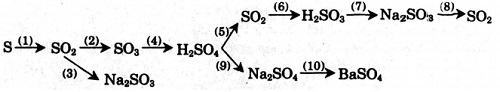
Hãy thực hiện những chuyển đổi hóa học sau bằng cách viết những phương trình phản ứng hóa học. (Ghi điều kiện của phản ứng, nếu có)
Bài giải :
(1) S + O2 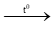
(2) 2SO2 + O2 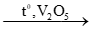
(3) SO2 + Na2O → Na2SO3
(4) SO3 + H2O → H2SO4
(5) 2H2SO4 (đ) + Cu 
(6) SO2 + H2O → H2SO3
(7) H2SO3 + 2 NaOH → Na2SO3 + 2H2O
(8) Na2SO3 + 2HCl → 2 NaCl + SO2 ↑ + H2O
(9) H2SO4 + 2 NaOH → Na2SO4 + 2H2O
(10) Na2SO4 + BaCl2 → BaSO4 ↓ + 2 NaCl
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 9 bài 5 :
Bài 5.1 trang 7
Có những chất sau : Cu, Zn, MgO, NaOH, Na2CO3. Hãy dẫn ra những phản ứng hoá học của dung dịch HCl và dung dịch H2SO4 loãng với những chất đã cho để chứng minh rằng hai axit này có tính chất hoá học giống nhau.
Bài giải :
Các dung dịch HCl, H2SO4 loãng tác dụng với kim loại (Zn), oxit bazơ (MgO), bazơ (NaOH) và muối (Na2CO3). Các dung dịch HCl, H2SO4 loãng không tác dụng với Cu.
Phương trình hóa học :
- Dung dịch HCl loãng :
Zn + HCl → ZnCl2 + H2
MgO + 2HCl → MgCl2 + H2O
NaOH + HCl → NaCl + H2O
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
- Dung dịch H2SO4 loãng :
Zn + H2SO4 → ZnSO4 + H2
MgO + H2SO4 → MgSO4 + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
Bài 5.2 trang 7
Để phân biệt được hai dung dịch Na2SO4 và Na2CO3, người ta dùng:
A. BaCl2 B. HCl C. Pb(NO3)2 D. NaOH.
Bài giải :
Để phân biệt được hai dung dịch Na2SO4 và Na2CO3 dùng dung dịch HCl :
– Có bọt khí thoát ra, nhận ra dung dịch Na2CO3.
– Không có bọt khí, nhận ra dung dịch Na2SO4.
⇒ Chọn đáp án B.
Bài 5.3 trang 7
Cho những chất sau:
A. CuO; B. MgO; C. H2O; D. SO2; E. CO2.
Hãy chọn những chất thích hợp đã cho để điền vào chỗ trống trong các phương trình hoá học sau:
(1) 2HCl + … → CuCl2 + …
(2) H2SO4 + Na2SO3 → Na2SO4 + … + …
(3) 2HCl + CaCO3 → CaCl2 +… + …
(4) H2SO4 + … → MgSO4 + …
(5) … + … ↔ H2SO3
Bài giải :
(1) A. CuO và C. H2O
(2) D. SO2 và C. H2O
(3) E. CO2 và C. H2O
(4) B. MgO và C. H2O
(5) D. SO2 và C. H2O
Bài 5.4 trang 7
Cho các chất : Cu, Na2SO3, H2SO4.
a) Viết các phương trình hoá học của phản ứng điều chế SO2 từ các chất trên.
b) Cần điều chế n mol SO2, hãy chọn chất nào để tiết kiệm được H2SO4. Giải thích cho sự lựa chọn.
Bài giải :
a) Phản ứng điều chế SO2:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2 ↑ (1)
2H2SO4 (đặc) + Cu → CuSO4 + 2H2O + SO2 ↑ (2)
b) Chọn Cu hay Na2SO3 ?
Theo phương trình (1) : Điều chế n mol SO2 cần n mol H2SO4.
Theo phương trình (2) : Điều chế n moi SO2 cần 2n mol H2SO4.
⇒ Vậy dùng Na2SO3 sẽ tiết kiệm được H2SO4.
Bài 5.5 trang 7
a) Viết các phương trình hoá học của phản ứng điều chế khí hiđro từ những chất sau: Zn, dung dịch HCl, dung dịch H2SO4.
b) So sánh thể tích khí hiđro (cùng điều kiện t° và p) thu được của từng cặp phản ứng trong những thí nghiệm sau:
Thí nghiệm 1:
0,1 mol Zn tác dụng với dung dịch HCl dư.
0,1 mol Zn tác dụng với dung dịch H2SO4 dư.
Thí nghiệm 2 :
0,1 mol H2SO4 tác dụng với Zn dư.
0,1 mol HCl tác dụng với Zn dư.
Bài giải :
a) Phương trình hóa học :
Zn + 2HCl → ZnCl2 + H2 ↑ (1)
Zn + H2SO4 → ZnSO4 + H2 ↑ (2)
b) So sánh thể tích khí hiđro sinh ra :
Thí nghiệm 1 : Dùng dư axit để hòa tan hoàn toàn lượng Zn tham gia phản ứng.
Theo phương trình (1) : 0,1 mol Zn điều chế được 0,1 mol H2.
Theo phương trình (2) : 0,1 mol Zn điều chế được 0,1 mol H2.
Kết luận : Những thể tích khí hiđro thu được trong thí nghiệm 1 là bằng nhau.
Thí nghiệm 2 : Dùng dư Zn để toàn lượng axit tham gia phản ứng.
Theo phương trình (1) : 0,1 mol HCl điều chế được 0,05 mol H2.
Theo phương trình (2) : 0,1 mol H2SO4 điều chế được 0,1 mol H2.
Kết luận : Những thể tích khí hiđro thu được trong thí nghiệm 2 là không bằng nhau. Thể tích khí hiđro sinh ra ở (2) nhiều gấp 2 lần ở (1).
Bài 5.6 trang 7
Để tác dụng vừa đủ với 44,8 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 cần phải dùng 400 ml dung dịch H2SO4 2M. Sau phản ứng thấy tạo ra a gam hỗn hợp muối sunfat. Hãy tính a.
Bài giải :
Phương trình hóa học :
FeO + H2SO4 → FeSO4 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Fe3O4 + 4H2SO4 → Fe2(SO4)3 + FeSO4 + 4H2O
Số mol H2SO4 đã phản ứng là :
nH2SO4 = mH2SO4 x MH2SO4 = 0,4 x 2 = 0,8 (mol)
Khối lượng H2SO4 đã phản ứng là :
mH2SO4 = nH2SO4 x MH2SO4 = 0,8 x 98 = 78,4 (gam)
Theo phương trình, ta có :
nH2O = nH2SO4 = 0,8 (mol)
→ mH2O = 0,8 x 18 = 14,4 (gam)
Theo các phương trình hoá học và định luật bảo toàn khối lượng ta có :
moxit + maxit = mmuối + mH2O
44,8 + 78,4 = mmuối + 14,4
⇒ mmuối = 108,8 (gam)
Vậy a = 108,8 (gam)
Bài 5.7 trang 7
Từ 80 tấn quặng pirit chứa 40% lưu huỳnh, người ta sản xuất được 73,5 tấn axit sunfuric.
a) Tính hiệu suất của quá trình sản xuất axit sunfuric.
b) Tính khối lượng dung dịch H2SO4 50% thu được từ 73,5 tấn H2SO4 đã được sản xuất ở trên.
Bài giải :
a) Khối lượng lưu huỳnh chứa trong 80 tấn quặng :
mS = 80 x 40% = 32 tấn
Điều chế H2SO4 theo sơ đồ sau :
S → SO2 → SO3 → H2SO4
32 g 98 g
32 tấn ? tấn
mH2SO4 = (32 x 98) / 32 = 98 tấn
Hiệu ứng phản ứng :
H = (73,5/98) x 100% = 75%
b) Khối lượng dung dịch H2SO4 50% thu được :
100 tấn dung dịch có 50 tấn H2SO4
x tấn ← 73,5 tấn
⇒ x = (73,5 x 100%) / 50% = 147 tấn
Đây là nội dung tóm tắt và giải bài tập Chương 1 bài 5 – Luyện tập: Tính chất hóa học của oxit và axit của chương trình hóa học lớp 9 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 9