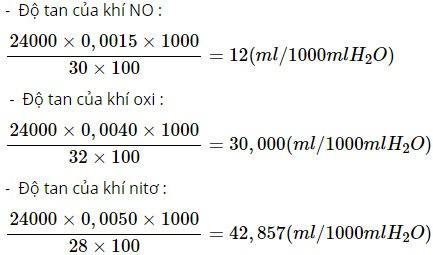Tóm tắt và giải hóa lớp 8 bài 41: Độ tan của một chất trong nước
Tóm tắt và giải hóa lớp 8 bài 41: Độ tan của một chất trong nước
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 41 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 8 bài 41:
– Tính tan của các hợp chất trong nước :
Axit: Hầu hết các axit tan được trong nước, trừ H2SiO3.
Bazơ: Phần lớn các bazơ không tan, trừ một số như : NaOH, KOH, Ba(OH)2 còn Ca(OH)2 ít tan.
Muối: Những muối natri, kali, nitrat đều tan. Phần lớn các muối clorua và sunfat tan được. Phần lớn muối cacbonat không tan.
– Độ tan (S) của một chất là số gam chất đó tan được trong 100 g nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
– Nói chung độ tan của chất rắn sẽ tăng nếu tăng nhiệt độ. Độ tan của chất khí sẽ tăng nếu giảm nhiệt độ và tăng áp suất.
2. Hướng dẫn giải bài tập Hóa học 8 bài 41:
Bài 1 trang 142
Hãy chọn câu trả lời đúng.
Độ tan của một chất trong nước ở nhiệt độ xác định là :
A. Số gam chất đó có thể tan trong 100 gam dung dịch.
B. Số gam chất đó có thể tan trong 100 gam nước.
C. Số gam chất đó có thể tan trong 100 gam dung môi để tạo thành dung dịch bão hòa.
D. Số gam chất đó có thể tan trong 100 gam nước để tạo thành dung dịch bão hòa.
Bài giải :
Độ tan của một chất là số gam chất đó tan được trong 100 g nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
⇒ Chọn đáp án D.
Bài 2 trang 142
Khi tăng nhiệt độ thì độ tan của các chất rắn trong nước:
A. Đều tăng B. Đều giảm C. Phần lớn là tăng
D. Phần lớn là giảm E. Không tăng và cũng không giảm
Bài giải :
Khi tăng nhiệt độ thì độ tan của các chất rắn trong nước phần lớn là tăng.
⇒ Chọn đáp án C.
Bài 3 trang 142
Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước:
A. Đều tăng
B. Đều giảm
C. Có thể tăng và có thể giảm
D. Không tăng và cũng không giảm
Bài giải :
Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước đều tăng.
⇒ Chọn đáp án A.
Bài 4 trang 142
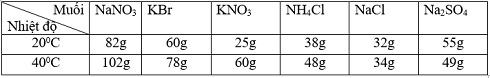
Dựa vào đồ thị về độ tan của các chất rắn trong nước (hình 6.5), hãy cho biết độ tan của các muối NaNO3, KBr, KNO3, NH4Cl, NaCl, Na2SO4 ở nhiệt độ 10oC và 60oC.
| Độ tan | NaNO3 | KBr | KNO3 | NH4Cl | NaCl | Na2SO4 |
| 10oC | 80 g | 60 g | 20 g | 30 g | 35 g | 60 g |
| 60oC | 130 g | 95 g | 110 g | 70 g | 38 g | 45 g |
Bài 5 trang 142
Xác định độ tan của muối Na2CO3 trong nước ở 180C. Biết rằng ở nhiệt độ này khi hòa tan hết 53 g Na2CO3 trong 250 g nước thì được dung dịch bão hòa.
Bài giải :
Ở nhiệt độ 18oC, 250 gam nước hòa tan 53 gam Na2CO3 để tạo dung dịch bão hòa.
Vậy ở nhiệt độ 18oC, 100 gam nước hòa tan S gam Na2CO3 để tạo dung dịch bão hòa.
S = (53 x 100) / 250 = 21,2 (g)
Theo định nghĩa về độ tan, ta có độ tan của Na2CO3 ở 18oC là 21,2 gam.
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 8 bài 41:
Bài 41.1 trang 56
Căn cứ vào đồ thị về độ tan của chất rắn trong nước (hình 6.5, SGK), hãy ước lượng độ tan của các muối NaNO3, KBr, KNO3, NH4Cl, NaCl và Na2SO4 ở nhiệt độ :
a) 20°C.
b) 40°C.
Bài giải :
Theo đồ thị, độ tan của muối vào khoảng :
Bài 41.2 trang 56
Căn cứ vào đồ thị về độ tan của chất khí trong nước (hình 6.6, SGK), hãy ước lượng độ tan của các khí NO, O2 và N2 ở 20°C. Hãy cho biết có bao nhiêu mililít những khí trên tan trong 1 lít nước. Biết rằng ở 20°c và 1 atm, 1 mol chất khí có thể tích là 24 lít và khối lượng riêng của nước là 1 g/ml.
Bài giải :
Theo đồ thị về độ tan của chất khí trong nước cùng nhiệt độ, áp suất :
SNO = 0,006g/100g H2O
SO2 = 0,0045g/100g H2O
SN2 = 0,002g/ 100g H2O
Chuyển đổi độ tan của các khí trên theo ml/1000 ml nước (20°c và 1 atm) :
Bài 41.3 trang 56
Tính khối lượng muối natri clorua NaCl có thể tan trong 750 g nước ở 25°C. Biết rằng ở nhiệt độ này độ tan của NaCl là 36,2 g.
Bài giải :
Ta có :
100 g nước ở 25°C hoà tan tối đa được 36,2 g NaCl.
750 g nước ở 25°C hoà tan tối đa được :
(36,2 x 750 ) / 100 = 271,5 (g) NaCl.
Bài 41.4 trang 56
Tính khối lượng muối AgNO3 có thể tan trong 250 g nước ở 25°C. Biết độ tan của AgNO3 ở 25°C là 222 g.
Bài giải :
Ta có :
100 g nước ở 25°C hòa tan tối đa 222 g AgNO3.
250 g nước ở 25°C hòa tan tối đa được :
(250 x 222) / 100 = 555 (g) AgNO3
Bài 41.5 trang 56
Biết độ tan của muối KCl ở 20°C là 34 g. Một dung dịch KCl nóng có chứa 50 g KCl trong 130 g H2O được làm lạnh về nhiệt độ 20°C. Hãy cho biết :
a) Có bao nhiêu gam KCl tan trong dung dịch.
b) Có bao nhiêu gam KCl tách ra khỏi dung dịch.
Bài giải :
a) Ta có :
100 g H2O ở 20ºC hòa tan được 34 g KCl
130 g H2O ở 20ºC hòa tan được :
(130 x 34) / 100 = 44,2 (g) KCl
b) Khối lượng KCl tách ra khỏi dung dịch là :
mKCl = 50 – 44,2 = 5,8 (g)
Bài 41.6 trang 57
Một dung dịch có chứa 26,5 g NaCl trong 75 g H2O ở 25°C. Hãy xác định dung dịch NaCl nói trên là chưa bão hoà hay bão hoà.
Biết độ tan của NaCl trong nước ở 25°C là 36 g.
Bài giải :
Ta có :
100 g H2O ở 25oC hòa tan 36 g NaCl
75 g H2O ở 25oC hòa tan được :
(75 x 36) / 100 = 27 (g)
Dung dịch NaCl đã pha chế là chưa bão hoà, vì dung dịch này có thể hoà tan thêm được : 27 – 26,5 = 0,5 (g) NaCl ở nhiệt độ 25°C.
Bài 41.7 trang 57
Có bao nhiêu gam NaNO3 sẽ tách ra khỏi 200 g dung dịch bão hòa NaNO3 ở 50oC, nếu dung dịch này được làm lạnh đến 20oC?
Biết SNaNO3(50ºC) = 114 g ; SNaNO3(20ºC) = 88 g
Bài giải :
Ở nhiệt độ 50ºC, 100 g H2O hòa tan được 114 g NaNO3.
⇒ mdd = 100 + 114 = 214 (g)
Nghĩa là trong 214 g dung dịch có 114 g NaNO3 được hòa tan.
Vậy 200 g dung dịch có khối lượng chất tan :
mNaNO3 = (200 x 144) / 214 ≈ 106,54 (g)
Gọi x là khối lượng của NaNO3 tách ra khỏi dung dịch, vậy khối lượng dung dịch NaNO3 là : mdd NaNO3 = (200 – x) (g)
Khối lượng NaNO3 hòa tan trong (200 – x) ở 20ºC là (106,54 – x) g
Theo đề bài : trong 100 + 88 = 188 (g) dung dịch ở 20ºC có hòa tan 88 g NaNO3. Vậy trong (200 – x) g dung dịch có hòa tan [88 x (200 – x)] / 188 g NaNO3.
Ta có phương trình đại số :
[88 x (200 – x)] / 188 = 106,54 – x
→ x ≈ 24,29 (g)
Vậy khối lượng NaNO3 tách ra khỏi dung dịch ở 20ºC là ≈ 24,29 (g)
Đây là nội dung tóm tắt và giải bài tập Chương 6 bài 41: Độ tan của một chất trong nước trong chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8