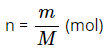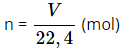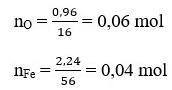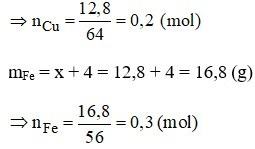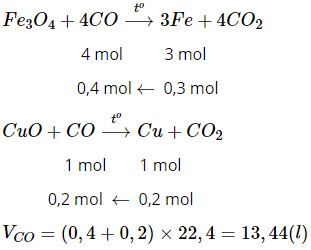Tóm tắt và giải hóa lớp 8 bài 23: Bài luyện tập 4
Tóm tắt và giải hóa lớp 8 bài 23: Bài luyện tập 4
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 23 mà bạn có thể tham khảo để học hóa tốt hơn!
1. Tóm tắt hóa học lớp 8 bài 23:
– Mol là lượng chất có chứa N (6.1023) nguyên tử hoặc phân tử chất đó.
– Khối lượng mol của một chất là khối lượng của N nguyên tử hoặc phân tử chất đó, tính bằng gam, có số trị bằng nguyên tử khối hoặc phân tử khối.
– Thể tích mol của chất khí là thể tích chiếm bởi N phân tử chất đó.
– Công thức chuyển đổi giữa lượng chất (n) và khối lượng chất (m) :
(M là khối lượng mol của chất).
– Công thức chuyển đổi giữa lượng chất (n) và thể tích của chất khí (V) ở điều kiện tiêu chuẩn :
– Công thức tính tỉ khối của:
- Khí A đối với khí B:
dA/B = MA / MB .
- Khí A đối với không khí:
dkk = MA / 29 .
2. Hướng dẫn giải bài tập Hóa học 8 bài 23:
Bài 1 trang 79
Hãy tìm công thức hóa học đơn giản nhất của một loại oxit của lưu huỳnh, biết rằng trong oxit này có 2 g lưu huỳnh kết hợp với 3 g oxi.
Bài giải:
Số mol của nguyên tử lưu huỳnh là:
nS = mS / MS = 2/32 = 1/16 (mol)
Số mol của nguyên tử oxi là:
nO = mO / MO = 3/16 (mol)
Ta có:
nS : nO = 1/16 : 3/16 = 1 : 3 (mol)
⇒ Trong một phân tử lưu huỳnh trioxit có 1 nguyên tử S và có 3 nguyên tử O.
⇒ Vậy công thức hóa học đơn giản nhất của oxit lưu huỳnh là SO3.
Bài 2 trang 79
Hãy tìm công thức hóa học của một hợp chất có thành phần theo khối lượng là : 36,8% Fe ; 21,0% S ; 42,2% O. Biết khối lượng mol của hợp chất bằng 152 g/mol.
Bài giải:
Khối lượng nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
mFe = 152 x 36,8% = (152 x 36,8) / 100 = 56 (g)
mO = 152 x 42,2% = (152 x 42,2) / 100 = 64 (g)
mS = 152 x 21% = (152 x 21) / 100 = 32 (g)
Số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất là:
nFe = mFe / MFe = 56/56 = 1 (mol)
nO = mO / MO = 64/16 = 4 (mol)
nS = mS / MS = 32/32 = 1 (mol)
⇒ Trong 1 phân tử hợp chất có 1 nguyên tử Fe, 4 nguyên tử O, 1 nguyên tử S.
⇒ Vậy công thức hóa học của hợp chất là FeSO4.
Bài 3 trang 79
Một hợp chất có công thức hóa học là K2CO3. Em hãy cho biết :
a) Khối lượng mol của chất đã cho.
b) Thành phần phần trăm (theo khối lượng) của các nguyên tố có trong hợp chất.
Bài giải:
a) Khối lượng mol của chất đã cho:
MK2CO3 = 39.2 + 12 + 16.3 = 138 (g)
b) Thành phần phần trăm (theo khối lượng) của các nguyên tố có trong hợp chất:
%K = (39.2.100%) / 138 = 56,5%
%C = (12.100%) / 138 = 8,7%
%O = 100% – (56,5% + 8,7%) = 34,8%
Bài 4 trang 79
Có phương trình hóa học sau:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
a) Tính khối lượng canxi clorua thu được khi cho 10 g canxi cacbonat tác dụng với axit clohiđric dư.
b) Tính thể tích khí cacbonic thu được trong phòng khi làm thí nghiệm, nếu có 5 g canxi cacbonat tác dụng hết với axit. Biết 1 mol khí ở điều kiện phòng có thể tích là 24 lít.
Bài giải:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
1 mol 1 mol 1 mol
a) Số mol canxi cacbonat tham gia phản ứng:
nCaCO3= mCaCO3 / MCaCO3 = 10/100 = 0,1 (mol)
Theo phương trình hóa học, ta có:
nCaCl2 = nCaCO3 = 0,1 (mol)
Khối lượng của canxi clorua tham gia phản ứng:
mCaCl2 = 0,1.(40 + 71) = 11,1 (g)
b) Số mol canxi cacbonat tham gia phản ứng:
nCaCO3 = 5/100 = 0,05 (mol)
Theo phương trình hóa học, ta có:
nCO2 = nCaCO3 = 0,05 (mol)
Thể tích khí CO2 ở điều kiện phòng là:
VCO2 = 24 . 0,05 = 1,2 (lít)
Bài 5 trang 79
Khí metan CH4 có trong khí tự nhiên hoặc trong khí bioga. Khí metan cháy trong không khí sinh ra khí cacbon đioxit và nước:
CH4 + 2O2 CO2 + 2H2O
a) Tính thể tích khí oxi cần dùng để đốt cháy hoàn toàn 2lít khí metan. Các thể tích khí đo cùng điều kiện to và p.
b) Tính thể tích khí CO2 (đktc) thu được sau khi đốt cháy hoàn toàn 0,15 mol khí metan.
c) Khí metan nặng hay nhẹ hơn không khí bằng bao nhiêu lần ?
Bài giải:
a) Theo phương trình hóa học:
nO2 = 2nCH4
Mà tỉ lệ về thể tích cũng là tỉ lệ về số mol, suy ra:
VO2 = 2.VCH4 = 2.2 = 4 (lít)
b) Theo phương trình hóa học:
nCO2 = nCH4 = 0,15 (mol)
Thể tích khí CO2 thu được ở đktc:
VCO2 = nCO2 . 22,4 =0,15 . 22,4 = 3,36 (lít)
c) Tỉ khối của khí metan và không khí là:
dCH4/kk = mCH4 / 29 = 16/29 ≈ 0,05
Vậy khí metan nhẹ hơn không khí 0,55 lần
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 8 bài 23:
Bài 23.1 trang 30
Hãy điền những chữ và số thích hợp vào chỗ trống trong các câu sau :
a) Một mol nguyên tử Cu có khối lượng ………… g và một mol nguyên tử lưu huỳnh có khối lượng ……….. g kết hợp với nhau tạo thành một ………… CuS có khối lượng …………. g.
b) ………….. g chì kết hợp với ………….. g oxi tạo ra một mol phân tử Pb3O4 có khối lượng ……….. g.
c) Trong 342 g đường C12H22O11 có ……….. mol ………….. C, ……………. mol …………… H và …………… mol …………. O. Khối lượng của ………….. C là …………. g, khối lượng của …………… H là …………. g, khối lượng của …………. O là …………… g.
Bài giải:
a) Một mol nguyên tử Cu có khối lượng 64 g và một mol nguyên tử lưu huỳnh có khối lượng 32 g kết hợp với nhau tạo thành một mol phân tử CuS có khối lượng 96 g.
b) 621(207 x 3) g chì kết hợp với 64 (16 x 4) g oxi tạo ra một mol phân tử Pb3O4 có khối lượng 685 g.
c) Trong 342 g đường C12H22O11 có 12 mol nguyên tử C, 22 mol nguyên tử H và 11 mol nguyên tử O. Khối lượng của 12 mol nguyên tử C là 144 g, khối lượng của 22 mol nguyên tử H là 22 g, khối lượng của 11 mol nguyên tử O là 176 g.
Bài 23.2 trang 30
Cho biết thành phần theo khối lượng của một số hợp chất, hãy tìm công thức hoá học của chúng.
– Hợp chất A : 0,2 mol hợp chất có chứa 4,6 g Na và 7,1 g Cl.
– Hợp chất B : 0,03 mol hợp chất có chứa 0,36 g C và 0,96 g O.
– Hợp chất C : 0,02 mol hợp chất có chứa 4,14 g Pb và 0,32 g O.
– Hợp chất D : 0,04 mol hợp chất có chứa 0,08 mol nguyên tử Fe và 0,12 mol nguyên tử O.
– Hợp chất E : 0,02 mol hợp chất có 0,04 mol nguyên tử Na, 0,02 mol nguyên tử c và 0,06 mol nguyên tử O.
Bài giải:
– Hợp chất A:
nNa = mNa / MNa = 4,6/23 =0,2 (mol)
nCl = mCl / MCl = 7,1/35,5 = 0,2 (mol)
Cứ 0,2 mol hợp chất A có chứa 0,2 mol Na và 0,2 mol Cl.
⇒ 1 mol hợp chất A có chứa 1 mol Na và 1 mol Cl.
⇒ Công thức hóa học đơn giản của A là NaCl.
– Hợp chất B:
nC = mC / MC = 0,36/12 = 0,03 (mol)
nO = mO / MO = 0,96/16 = 0,06 (mol)
Vậy cứ 0,03 mol phân tử B có chứa 0,03 mol phân tử C và 0,06 mol nguyên tử O.
⇒ 1 mol phân tử B có chứa 1 mol nguyên tử C và 2 mol nguyên tử O.
⇒ Công thức hóa học của B là CO2.
– Hợp chất C:
nPb = mPb / MPb = 4,14/207 = 0,02 (mol)
nO = mO / MO = 0,32/16 = 0,02 (mol)
Vậy 0,02 mol phân tử C có chứa 0,02 mol nguyên tử Pb và 0,02 mol nguyên tử O.
⇒ 1 mol phân tử C có chứa 1 mol nguyên tử Pb và 1 mol nguyên tử O.
⇒ Công thức của phân tử C là: PbO.
– Hợp chất D:
Theo đề bài: 0,04 mol phân tử D có 0,08 mol Fe và 3 mol O.
⇒ 1 mol phân tử D có 2 mol Fe và 0,12 mol O.
⇒ Công thức hóa học của D là Fe2O3.
– Hợp chất E:
Cho biết: 0,02 mol phân tử E có 0,04 mol Na kết hợp 0,02 mol C và 0,06 mol nguyên tử O.
⇒ 1 mol phân tử E có 2 mol Na kết hợp 1 mol C và 3 mol O.
⇒ Công thức hóa học của E là Na2CO3.
Bài 23.3 trang 31
Nung hợp chất canxi cacbonat trong một chén nung, người ta thu được vôi sống có công thức hoá học là CaO và khí thoát ra là CO2. Kết quả của thí nghiệm được ghi lại như sau :
– Khối lượng của chén nung rỗng là 30 g.
– Khối lượng của chén nung và canxi cacbonat là 40 g.
– Khối lượng của chén nung và CaO là 35,6 g.
Hãy điền vào dấu chấm trong những câu sau :
+ Khối lượng của CaO có trong chén sau khi nung là … g .
+ Số mol của CaO là …
+ Khối lượng khí CO2 thoát ra sau phản ứng là …….. g.
+ Số mol của CO2 là ………
+ Phân tử canxi cacbonat bị phân huỷ thành CaO và CO2, có tỉ lệ số phân tử CaO/số phân tử CO2 là … / …..
Bài giải:
+ Khối lượng của CaO có trong chén sau khi nung là: 36,6 – 30 = 5,6 (g)
+ Số mol của CaO là 5,6 / 56 = 0,1 (mol)
+ Khối lượng khí CO2 thoát ra sau phản ứng là 40 – 35,6 = 4,4 g.
+ Số mol của CO2 là 4,4 / 44 = 0,1 (mol)
+ Phân tử canxi cacbonat bị phân huỷ thành CaO và CO2, có tỉ lệ số phân tử CaO/số phân tử CO2 là 1/1
Bài 23.4 trang 31
Đốt cháy hoàn toàn cacbon bằng một lượng khí oxi dư, người ta thu được hỗn hợp khí gồm có khí cacbonic (CO2) và khí oxi (O2) dư.
Hãy xác định thành phần phần trăm theo khối lượng và thành phần phần trăm theo thể tích của khí oxi trong mỗi hỗn hợp sau :
a) 4 g khí cacbonic và 16 g khí oxi.
b) 3 mol khí cacbonic và 5 moi khí oxi.
c) 0,3.1023 phân tử CO2 và 0,9.1023 phân tử O2.
Bài giải:
a) Thành phần phần trăm theo khối lượng là:
mhh khí = 4 + 6 = 20 (g)
%mCO2 = (4/20) x 100% = 20%
%mO2 = 100% – 20% = 80%
Thành phần phần trăm theo thể tích:
nCO2 = mCO2 / MCO2 = 4/44 ≈ 0,09 (mol)
nO2 = mO2 / MO2 = 16/32 = 0,5 (mol)
nhh = nCO2 + nO2 = 0,09 + 0,5 = 0,59 (mol)
%VCO2 = (0,09/0,59) x 100% ≈ 15,25%
%VO2 = 100% – 15,25% = 84,75%
b) Khối lượng của các khí:
mCO2 = nCO2 x MCO2 = 3 x 44 = 132 (g)
mO2 = nO2 x MO2 = 5 x 32 = 160 (g)
Thành phần phần trăm theo khối lượng:
mhh = mCO2 + mO2 = 132 + 160 = 292 (g)
%mCO2 = (132/292) x 100% = 45,2%
%mO2 = 100% – 45,2% = 54,8%
Thành phần phần trăm theo thể tích:
nhh = nCO2 + nO2 = 3 + 5 = 8 (mol)
%VCO2 = (3/8) x 100% = 37,5%
%VO2 = 100% – 37,5% = 62,5%
c) Khối lượng của các khí là:
nCO2 = 0,3.1023 / 6.1023 = 0,05 (mol)
⇒ mCO2 = nCO2 x MCO2 = 0,05 x 44 = 2,2 (g)
nO2 = 0,9.1023 / 6.1023 = 0,15 (mol)
⇒ mO2 = nO2 x MO2 = 0,15 x 32 = 4,8 (g)
Thành phần phần trăm theo khối lượng là:
mhh = mCO2 + mO2 = 2,2 + 4,8 = 7 (g)
%mCO2 = (2,2/7) x 100% = 31,43%
%mO2 = 100% – 31,43% = 68,57%
Thành phần phần trăm theo thể tích:
nhh = nCO2 + nO2 = 0,05 + 0,15 = 0,2 (mol)
%VCO2 = (0,05/0,2) x 100% = 25%
%VO2 = 100% – 25% = 75%
Bài 23.5 trang 31
Hãy xác định khối lượng và thể tích của những hỗn hợp khí sau ở đktc :
a) 1,5 N phân tử oxi + 2,5 N phân tử hiđro + 0,02 N phân tử nitơ.
b) 1,5 mol phân tử oxi + 1,2 mol phân tử CO2 + 3 mol phân tử nitơ.
c) 6 g khí hiđro + 2,2 g khí cacbonic + 1,6 g khí oxi.
Bài giải:
a) Khối lượng của các khí:
mO2 = nO2 x MO2 = 1,5 x 32 = 48 (g)
mN2 = nN2 x MN2 = 0,02 x 28 = 0,56 (g)
mH2 = nH2 x MH2 = 2,5 x 2 = 5 (g)
Khối lượng hỗn hợp khí:
mhh = mO2 + mH2 + mN2 = 48 + 5 + 0,56 = 53,56 (g)
Thể tích của hỗn hợp khí:
Vhh = 22,4 x n = 22,4 x ( 1,5 + 2,5 + 0,02) = 90,048 (l)
b) Khối lượng của các khí:
mO2 = nO2 x MO2 = 1,5 x 32 = 48 (g)
mCO2 = nCO2 x MCO2 = 1,2 x 44 = 52,8 (g)
mN2 = nN2 x MN2 = 3 x 28 = 84 (g)
Khối lượng hỗn hợp khí:
mhh = mO2 + mCO2 + mN2 = 48 + 52,8 + 84 = 184,8 (g)
Thể tích của hỗn hợp khí:
Vhh = 22,4 x n = 22,4 x (1,5 + 1,2 + 3) = 127,68 (l)
c) Khối lượng hỗn hợp khí:
mhh = mH2 + mCO2 + mO2 = 6 + 2,2 + 1,6 = 9,8 (g)
nH2 = mH2 / MH2 = 6/2 = 3 (mol)
nCO2 = mCO2 / MCO2 = 2,2/(12 + 16.2) = 0,05 (mol)
nO2 = mO2 / MO2 = 1,6/32 = 0,05 (mol)
Vhh = 22,4 x nhh = 22,4.(3 + 0,05 + 0,05) = 69,44 (l)
Bài 23.6 trang 31
Đốt cháy hoàn toàn 2,24 g Fe, thu được 3,2 g oxit sắt. Xác định công thức phân tử của oxit sắt.
Bài giải:
Cách 1:
Cách 2:
Khối lượng Oxi trong oxit là: 3,2 – 2,24 = 0,96 (g)
Tỉ lệ:
nFe : nO = 0,04 : 0,06 = 2:3
⇒ Trong 1 phân tử oxit có 2 nguyên tử Fe, 3 nguyên tử O.
⇒ Công thức hóa học của oxit là: Fe2O3.
Bài 23.7 trang 31
Cho dòng khí CO dư qua hỗn hợp 2 oxit CuO và Fe3O4 nung nóng thu được 29,6 g hỗn hợp 2 kim loại trong đó sắt nhiều hơn đồng là 4 g. Tính thể tích khí CO cần dùng (đktc).
Bài giải:
Gọi x là khối lượng của Cu sau phản ứng.
Khối lượng của sắt sau phản ứng là x + 4
Theo đề bài ta có:
x + x + 4 = 29,6 ⇒ x = 12,8 (g)
Phương trình hóa học của phản ứng là:
Bài 23.8 trang 31
Cho 20 g một oxit sắt phản ứng hết với dung dịch HCl dư, sau phản ứng thu được 40,625 g muối clorua. Xác định công thức phân tử của oxit sắt.
Bài giải:
Đây là nội dung tóm tắt và giải bài tập Chương 3 bài 23: Bài luyện tập 4 của chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8