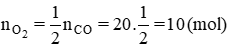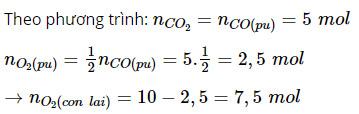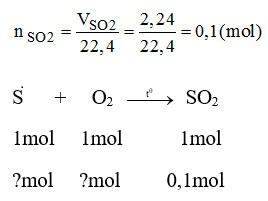Tóm tắt và giải hóa lớp 8 bài 22: Tính theo phương trình hóa học
Tóm tắt và giải hóa lớp 8 bài 22: Tính theo phương trình hóa học
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 22 mà bạn có thể tham khảo để học hóa tốt hơn!
1. Tóm tắt hóa học lớp 8 bài 22:
Các bước tiến hành:
1) Viết phương trình hóa học.
2) Chuyển đổi khối lượng chất hoặc thể tích chất khí thành số mol chất.
3) Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất tạo thành.
4) Chuyển đổi số mol chất thành khối lượng (m = n x M) hoặc thể tích khí ở đktc (V = 22,4 x n)
2. Hướng dẫn giải bài tập Hóa học 8 bài 22:
Bài 1 trang 75
Sắt tác dụng với axit clohiđric : Fe + 2HCl → FeCl2 + H2.
Nếu có 2,8 g sắt tham gia phản ứng, em hãy tìm :
a) Thể tích khí hiđro thu được ở đktc.
b) Khối lượng axit clohiđric cần dùng.
Bài giải:
Số mol sắt tham gia phản ứng là:
nFe = 2,8 / 56 = 0,05 (mol)
a) Phương trình phản ứng:
Theo phương trình:
nH2 = nFe = 0,05 (mol)
Thể tích khí thu được ở đktc là:
VH2 = 22,4 x n = 22,4 x 0,05 = 1,12 (l)
b)
Theo phương trình:
nHCl = 2 x nFe = 2 x 0,05 = 0,1 (mol)
Khối lượng của axit clohiđric cần dùng là:
mHCl = nHCl x MHCl = 0,1 x 36,5 = 3,65 (g)
Bài 2 trang 75
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit (còn gọi là khí sunfurơ) có công thức hóa học là SO2.
a) Viết phương trình hóa học của phản ứng lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 g. Hãy tìm :
– Thể tích khí lưu huỳnh đioxit sinh ra ở đktc.
– Thể tích không khí cần dùng ở đktc. Biết khí oxi chiếm 1/5 thể tích của không khí.
Bài giải:
a) Phương trình hóa học của S cháy trong không khí là:
S + O2 SO2
b) Số mol của S tham gia phản ứng là:
nS = mS / MS = 1,6 / 32 = 0,05 (mol)
Theo phương trình trên, ta có:
nSO2 = nS = nO2 = 0,05 (mol)
Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2 = nSO2 x 22,4 = 0,05 x 22,4 = 1,12 l
Thể tích khí oxi cần dùng ở đktc là:
VO2 = nO2 x 22,4 = 22,4 x 0,05 = 1,12 l
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần dùng ở đktc là:
Vkk = 5VO2 = 5 x 1,12 = 5,6 l
Bài 3 trang 75
Có phương trình hóa học sau :
CaCO3 CaO + CO2
a) Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2 g CaO ?
b) Muốn điều chế được 7 g CaO cần dùng bao nhiêu gam CaCO3 ?
c) Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc) ?
d) Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng ?
Bài giải:
Phương trình hóa học:
CaCO3 CaO + CO2
a) Số mol CaO tạo thành sau phản ứng là:
nCaO = 11,2 / 56 = 0,2 (mol)
Theo phương trình hóa học:
nCaCO3 = nCaO = 0,2 (mol)
Vậy cần dùng 0,2 mol CaCO3 để điều chế 11,2 g CaO.
b) Số mol CaO tạo thành sau phản ứng là:
nCaO = 7 / 56 = 0,125 (mol)
Theo phương trình hóa học:
nCaCO3 = nCaO = 0,125 (mol)
Khối lượng CaCO3 cần dùng là:
mCaCO3 = MCaCO3 x nCaCO3 = 100 x 0,125 = 12,5 (g)
Vậy muốn điều chế 7 g CaO cần dùng 12,5 g CaCO3.
c) Theo phương trình hóa học:
nCO2 = nCaCO3 = 3,5 (mol)
Thể tích khí CO2 sinh ra là:
VCO2= 22,4 x nCO2 = 22,4 x 3,5 = 78,4 (lít)
Vậy 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra 78,4 lít khí CO2 ở đktc.
d) Số mol CO2 tạo thành sau phản ứng là:
nCO2 = 13,44 / 22,4 = 0,6 (mol)
Theo phương trình hóa học:
nCaO = nCaCO3 = nCO2 = 0,6 (mol)
Khối lượng CaCO3 tham gia là:
mCaCO3 = nCaCO3 x MCaCO3 = 0,6 x 100 = 60 (gam)
Khối lượng chất rắn tạo thành là:
mCaO = nCaO x MCaO = 0,6 x 56 = 33,6 (g)
Bài 4 trang 75
a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học.
b) Nếu muốn đốt cháy 20 mol CO thì phải dùng bao nhiêu mol O2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất ?
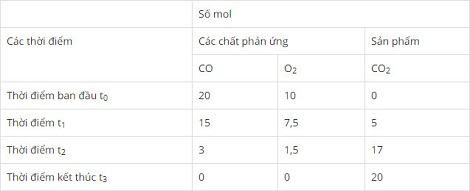
c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học.
Bài giải:
a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình hóa học:
c) Bảng số mol các chất:
Thời điểm t1 nCO còn 15 mol ⇒ nCO đã phản ứng = 20 – 15= 5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
Bài 5 trang 76
Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A.
Biết rằng :
– Khí A có tỉ lệ khối đối với không khí là 0,552.
– Thành phần theo khối lượng của khí A là : 75% C và 25% H.
Các thể tích khí đo ở đktc.
Bài giải:
Ta có: dA/kk = 0,552 ⇒ Khối lượng mol của khí A: MA = 29 x 0,552 = 16 (g)
Khối lượng của từng nguyên tố trong 1 mol khí A là:
mC = 16 x 75% = (16 x 75)/100 = 12 g
mH = 16 x 25% = (16 x 25)/100 = 4 g
Số mol của từng nguyên tố trong 1 mol khí A là:
nC = 12/12 = 1 mol
nH = 4/1 = 4 mol
⇒ 1 mol khí A có: 1 mol nguyên tử C và 4 mol nguyên tử H.
Công thức hóa học của khí A là: CH4.
Phương trình hóa học:
CH4 + 2O2 CO2 + 2H2O
Theo phương trình hóa học: nO2 = 2nCH4
⇒ VO2 = 2 x VCH4 = 2 x 11,2 = 22,4(l)
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 8 bài 22:
Bài 22.1 trang 29
Đốt cháy 3,25 g một mẫu lưu huỳnh không tinh khiết trong khí oxi dư, người ta thu được 2,24 lít khí sunfurơ (đktc).
a) Hãy viết phương trình hoá học xảy ra.
b) Bằng cách nào ta có thể tính được độ tinh khiết của mẫu lưu huỳnh đã dùng ?
c) Căn cứ vào phương trình hoá học trên, ta có thể trả lời ngay được thể tích khí oxi (đktc) vừa đủ để đốt cháy lưu huỳnh là bao nhiêu lít ?
Bài giải:
a) Phương trình hóa học:
S + O2 SO2
b)
Theo phương trình: 1 mol S tham gia phản ứng sinh ra 1 mol SO2
Số mol của lưu huỳnh tham gia phản ứng:
nS = 0,1.1 / 1 = 0,1 mol
Khối lượng của lưu huỳnh tinh khiết:
mS = nS x MS =0,1 x 32 = 3,2 (g)
Độ tinh khiết của mẫu lưu huỳnh:
(3,2/3,25) x 100% ≈ 98,5%
c) Theo phương trình: 1 mol O2 phản ứng sinh ra 1 mol SO2
Tỉ lệ thể tích cũng chính là tỉ lệ về số mol nên thể tích O2 thu được 2,24 lít
Bài 22.2 trang 29
Trong phòng thí nghiệm, người ta có thể điều chế khí oxi bằng cách đốt nóng kali clorat:
KClO3 2KCl + 3O2
(rắn) (rắn) (khí)
Hãy dùng phương trình hoá học trên để trả lời những câu hỏi sau :
a) Muốn điều chế được 4,48 lít khí oxi (đktc) cần dùng bao nhiêu gam KClO3 ?
b) Nếu có 1,5 mol KClO3 tham gia phản ứng, sẽ thu được bao nhiêu gam khí oxi ?
c) Nếu có 0,1 mol KClO3 tham gia phản ứng, sẽ thu được bao nhiêu mol chất rắn và chất khí ?
Bài giải:
Bài 22.3 trang 29
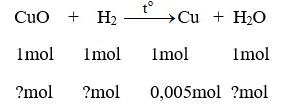
Cho khí hiđro dư đi qua đồng(II) oxit nóng màu đen, người ta thu được 0,32 g kim loại đồng màu đỏ và hơi nước ngưng tụ.
a) Viết phương trình hoá học xảy ra.
b) Tính khối lượng đồng(II) oxit tham gia phản ứng.
c) Tính thể tích khí hiđro ở đktc đã tham gia phản ứng.
d) Tính lượng nước ngưng tụ thu được sau phản ứng.
Bài giải:
a) Phương trình hóa học:
CuO + H2 Cu + H2O
b) Khối lượng CuO tham gia phản ứng :
Số mol Cu thu được sau phản ứng :
nCuO = 0,32 / 64 = 0,005 (mol)
Theo phương trình hóa học:
Số mol của CuO là:
nCuO = (0,05.1) / 1 = 0,05 (mol)
Khối lượng CuO tham gia phản ứng :
mCuO = nCuO x MCuO = 0,005 x 80 = 0,4 (g)
c) Theo phương trình hoá học, số mol H2 tham gia phản ứng bằng số mol Cu sinh ra sau phản ứng và bằng 0,005 mol.
Thể tích khí hiđro ở đktc tham gia phản ứng:
VH2 = nH2 x 22,4 = 0,005 x 22,4 = 0,112 (l)
d) Khối lượng nước ngưng tụ sau phản ứng :
Cách 1:
Theo phương trình hoá học, số mol H2O thu được sau phản ứng bằng số mol Cu sinh ra và bằng 0,005 mol, có khối lượng là :
mH2O = nH2O x MH2O = 0,005 x 18 = 0,09 (g)
Cách 2:
Theo định luật bảo toàn khối lượng, em cũng tính được khối lượng nước sinh ra sau phản ứng :
mH2O = mCuO + mH2 – mCu
= 0,4 + (2 x 0,005) – 0,32 = 0,09 (g)
Bài 22.4 trang 30
Đốt nóng 1,35 g bột nhôm trong khí clo, người ta thu được 6,675 g nhôm clorua. Em hãy cho biết:
a) Công thức hoá học đơn giản của nhôm clorua, giả sử rằng ta chưa biết hoá trị của nhôm và clo.
b) Phương trình hoá học của phản ứng nhôm tác dụng với khí clo.
c) Thể tích khí clo (đktc) đã tham gia phản ứng với nhôm.
Bài giải:
a) Công thức hoá học đơn giản của nhôm clorua :
Khối lượng clo có trong lượng nhôm clorua thu được :
mCl = mAlCl3 – mAl = 6,675 – 1,35 = 5,325 (g)
Số mol Al và Cl đã kết hợp với nhau tạo thành nhôm clorua:
nAl = mAl / mAl = 1,35 / 27 =0,05 (mol)
nCl = mCl / MCl = 5,325 / 35,5 = 0,15 (mol)
⇒ Trong hợp chất nhôm clorua, số mol Cl gấp 3 lần số mol Al → Số nguyên tử Cl gấp 3 lần số nguyên tử Al.
⇒ Công thức hoá học đơn giản của nhôm clorua là AlCl3
b) Phương trình hóa học:
2Al + 3Cl2 → 2AlCl3
c) Số mol phân tử Cl2 tham gia phản ứng :
nCl2 = mCl2 / MCl2 = 5,325 / 71 = 0,075 (mol)
Thể tích khí clo (đktc) tham gia phản ứng :
VCl2 = 22,4 x nCl2 = 22,4 x 0,075 = 1,68 (l)
Bài 22.5 trang 30
Đốt khí hiđro trong khí oxi người ta nhận thấy cứ 2 thể tích hiđro kết hợp với 1 thể tích oxi tạo thành nước.
a) Hãy tìm công thức hoá học đơn giản của nước.
b) Viết phương trình hoá học xảy ra khi đốt hiđro và.oxi.
c) Sau phản ứng, người ta thu được 1,8 g nước. Hãy tìm thể tích các khí hiđro và oxi tham gia phản ứng ở đktc.
Bài giải:
a) Vì 2 thể tích khí hidro kết hợp với 1 thể tích khí oxi có nghĩa là:
VH2 = 2VO2 hay nH2 = 2nO2
→ 2 phân tử H2 kết hợp với 1 phân tử O2.
Vậy công thức đơn giản của nước là H2O.
b) Phương trình hóa học:
2H2 + O2 2H2O
c) Số mol H2O thu được sau phản ứng :
nH2O = 1,8 / 18 = 0,1 (mol)
Theo phương trình hoá học : nH2 = 2nO2. Thể tích các khí hiđro và oxi tham gia phản ứng ở đktc là :
VH2 = nH2 x 22,4 = 0,1 x 22,4 = 2,24 (l)
VO2 = (nH2 /2) x 22,4 = (0,1/2) x 2,24 = 1,12 (l)
Đây là nội dung tóm tắt và giải bài tập Chương 3 bài 22: Tính theo phương trình hóa học của chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8