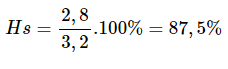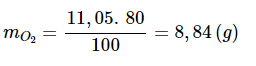Tóm tắt và giải hóa lớp 8 bài 15: Định luật bảo toàn khối lượng
Tóm tắt và giải hóa lớp 8 bài 15: Định luật bảo toàn khối lượng
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 15 mà bạn có thể tham khảo để học hóa tốt hơn!
1. Tóm tắt hóa học lớp 8 bài 15:
– Định luật bảo toàn khối lượng: ”Trong một phản ứng hóa học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng.”
– Áp dụng: Trong một phản ứng có n chất, kể cả chất phản ứng và sản phẩm, nếu biết khối lượng của (n – 1) chất thì tính được khối lượng của chất còn lại.
2. Hướng dẫn giải bài tập Hóa học 8 bài 15:
Bài 1 trang 54
a) Phát biểu định luật bảo toàn khối lượng.
Định luật bảo toàn khối lượng: ”Trong một phản ứng hóa học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng.”
b) Giải thích vì sao trong một phản ứng hóa học tổng khối lượng các chất được bảo toàn.
Trong phản ứng hóa học diễn ra sự thay đổi liên kết giữa các nguyên tử. Sự thay đổi này chỉ liên quan đến electron, còn số nguyên tử mỗi nguyên tố giữ nguyên và khối lượng nguyên tử thì không đổi, vì vậy tổng khối lượng các chất được bảo toàn.
Bài 2 trang 54
Trong phản ứng hóa học ở thí nghiệm trên, cho biết khối lượng của natri sunfat Na2SO4 là 14,2 g, khối lượng của các sản phẩm bari sunfat BaSO4 và natri clorua NaCl theo thứ tự là 23,3 g và 11,7 g.
Hãy tính khối lượng của bari clorua BaCl2 đã phản ứng.
Bài giải:
Phương trình chữ của phản ứng:
Natri sunfat + Bari clorua → Bari sunfat + Natri clorua
Theo định luật bảo toàn khối lượng ta có:
mBaCl2 + mNa2SO4 = mBaSO4 + mNaCl
⇒ mBaCl2 = mBaSO4 + mNaCl – mNa2SO4
⇒ mBaCl2 = 23,3 + 11,7 – 14,2 = 20,8 (g)
Vậy khối lượng của bari clorua (BaCl2) đã phản ứng là 20,8g.
Bài 3 trang 54
Đốt cháy hết 9 g kim loại magie Mg trong không khí thu được 15 g hợp chất magie oxit MgO. Biết rằng magie cháy là xảy ra phản ứng với khí oxi O2 trong không khí.
a) Viết công thức về khối lượng của phản ứng xảy ra.
b) Tính khối lượng của khí oxi đã phản ứng.
Bài giải:
a) Công thức về khối lượng của phản ứng:
mMg + mO2 = mMgO
b) Khối lượng của khí oxi đã phản ứng:
mO2= mMgO – mMg = 15 – 9 = 6 (g)
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 8 bài 15:
Bài 15.1 trang 20
a) Viết công thức về khối lượng cho phản ứng giữa kim loại kẽm và axit clohiđric HCl tạo ra chất kẽm clorua ZnCl2 và khí hiđro. (Xem lại hình 2.6, trong SGK về phản ứng này).
b) Cho biết khối lượng của kẽm và axit clohiđric đã phản ứng là 6,5 g và 7,3 g, khối lượng của chất kẽm clorua là 13,6 g.
Hãy tính khối lượng của khí hiđro bay lên.
Bài giải:
a) Theo định luật bảo toàn khối lượng ta có:
mZn + mHCl = mZnCl2 + mH2
b) Khối lượng của khí hiđro bay lên:
mH2 = (mZn + mHCl) – mZnCl2 = (6,5 + 7,3) – 13,6 = 0,2 (g)
Bài 15.2 trang 20
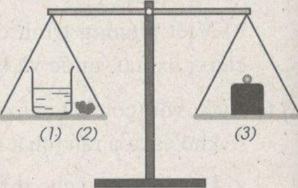
Biết rằng axit clohiđric có phản ứng với chất canxi cacbonat tạo ra chất canxi clorua, nước và khí cacbon đioxit.
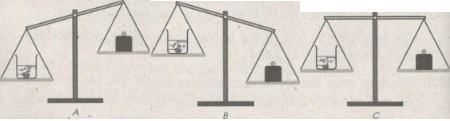
Một cốc đựng dung dịch axit clohiđric (1) và cục đá vôi (2) (thành phần chính là chất canxi cacbonat) được đặt trên một đĩa cân. Trên đĩa cân thứ hai đặt quả cân (3) vừa đủ cho cân ở vị trí thăng bằng.
Bỏ cục đá vôi vào dung dịch axit clohiđric. Sau một thời gian phản ứng, cân sẽ ở vị trí nào : A, B hay C ? Giải thích.
Bài giải:
Sau một thời gian có một lượng khí cacbon đioxit (CO2) thoát ra làm cho khối lượng hụt đi.
Phương trình hóa học:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
⇒ Chọn vị trí B.
Bài 15.3 trang 20
Hãy giải thích vì sao :
a) Khi nung nóng cục đá vôi thì thấy khối lượng giảm đi. (Xem lại bài tập 12.3 về đá vôi trong lò nung vôi).
b) Khi nung nóng miếng đồng trong không khí (có khí oxi) thì thấy khối lượng tăng lên. (Xem bài tập 3, thuộc bài 15, SGK ; khi đun nóng kim loại đồng (Cu) cũng có phản ứng tương tự kim loại magie (Mg)).
Bài giải:
a) Khi nung nóng cục đá vôi thì chất canxi cacbonat bị phân huỷ thành chất canxi oxit và khí cacbon đioxit thoát ra nên khối lượng giảm đi.
b) Vì khi nung nóng miếng đồng trong không khí thì đồng hóa hợp với khí oxi tạo ra chất mới nên khối lượng tăng. (khối lượng sau gồm khối lượng miếng đồng ban đầu + khối lượng oxi phản ứng)
Bài 15.4 trang 20
Đun nóng mạnh hỗn hợp gồm 28 g bột sắt và 20 g bột lưu huỳnh thu được 44 g chất sắt(II) sunfua (FeS) màu xám.
Biết rằng, để cho phản ứng hoá hợp xảy ra hết người ta đã lấy dư lưu huỳnh. Tính khối lượng lưu huỳnh lấy dư.
Bài giải:
Theo định luật bảo toàn khối lượng ta có:
mFe + mS = mFeS
Khối lượng lưu huỳnh đã hóa hợp với sắt là:
mS = mFeS – mFe = 44 – 28 = 16 (g)
Khối lượng lưu huỳnh lấy dư là:
20 – 16 = 4 (g)
Bài 15.5 trang 21
Biết rằng canxi oxit (vôi sống) CaO hóa hợp với nước tạo ra canxi hiđroxit (vôi tôi) Ca(OH)2, chất này tan được trong nước, cứ 56 g CaO hóa hợp vừa đủ với 18 g H2O. Bỏ 2,8 g CaO vào trong một cốc lớn chứa 400 ml nước tạo ra dung dịch Ca(OH)2, còn gọi là nước vôi trong.
a) Tính khối lượng của canxi hiđroxit.
b) Tính khối lượng của dung dịch Ca(OH)2, giả sử nước trong cốc là nước tinh khiết.
Bài giải:
a) Khối lượng của canxi hiđroxit:
Ta có:
Cứ 56(g) CaO hóa hợp vừa đủ với 18(g) H2O.
Vậy 2,8(g) CaO hóa hợp vừa đủ với x(g) H2O.
⇒ x = (2,8 x 18)/56 = 0,9 (g)
Theo định luật bảo toàn khối lượng ta có:
2,8 + 0,9 = 3,7 (g)
Vậy khối lượng của Ca(OH)2 là 3,7g.
b) Khối lượng của dung dịch Ca(OH)2:
Khối lượng của dung dịch Ca(OH)2 bằng khối lượng của CaO bỏ vào cốc cộng với khối lượng của 400 ml nước trong cốc. Vì là nước tinh khiết có D = 1 g/ml, nên khối lượng của dung dịch bằng :
Bài 15.6 trang 21
Đun nóng 15,8 g kali pemanganat (thuốc tím) KMnO4 trong ống nghiệm để điều chế khí oxi. Biết rằng, chất rắn còn lại trong ống nghiệm có khối lượng 12,6 g; khối lượng khí oxi thu được là 2,8 g.
Tính hiệu suất của phản ứng phân huỷ.
Bài giải:
Theo định luật bảo toàn khối lượng ta có:
mthuốc tím = mO2 + mchất rắn
⇒ mO2 = mthuốc tím – mchất rắn = 15,8 – 12,6 = 3,2 (g)
Hiệu suất của phản ứng phân hủy:
Bài 15.7 trang 21
Còn có thể điều chế khí oxi bằng cách đun nóng kali clorat KClO3 (chất rắn màu trắng). Khi đun nóng 24,5 g KClO3, chất rắn còn lại trong ống nghiêm có khối lượng là 13,45 g.
Tính khối lượng khí oxi thu được, biết hiệu suất của phản ứng phân huỷ là 80%. (Xem hướng dẫn bài tập 15.6*).
Bài giải:
Tương tự bài tâp 15.6, theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
mO2 = 24,5 – 13,45 = 11,05 (g)
Khối lượng thực tế oxi thu được là:
Đây là nội dung tóm tắt và giải bài tập Chương 2 bài 15: Định luật bảo toàn khối lượng của chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8