Tóm tắt và giải hóa lớp 11 bài 1: Sự điện li
Tóm tắt và giải hóa lớp 11 bài 1: Sự điện li
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 11 bài 1 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 11 bài 1:
a) Điện li
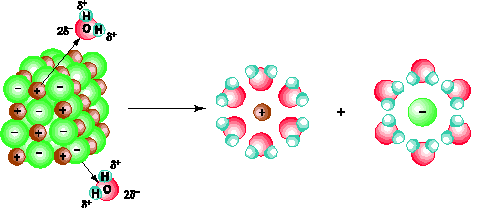
– Dung dịch dẫn điện được là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là các ion.
– Quá trình phân li các chất trong nước ra ion là sự điện li.
– Chất điện li là những chất khi tan trong nước phân li ra ion.
– Axit, bazơ, muối đều là những chất điện li.
b) Phân loại
– Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li hoàn toàn ra ion.
– Các axit mạnh, bazơ mạnh và hầu hết các muối là chất điện li mạnh.
– Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
– Chất không điện li là những chất khi tan trong nước không phân li ra ion.
– Cân bằng điện li: Sự phân li của các chất điện li yếu là quá trình thuận nghịch, khi tốc độ phân li của phân tử chất điện li (phản ứng thuận) bằng tốc độ kết hợp giữa các ion thành phân tử chất điện li (phản ứng nghịch) thì cân bằng của quá trình điện li được thiết lập.
– Cân bằng điện li là cân bằng động.
2. Hướng dẫn giải bài tập Hóa học 11 bài 1:
Bài 1 trang 7
Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện là do nguyên nhân gì ?
Bài giải:
Các dung dịch HCl, NaOH, NaCl dẫn điện được vì khi hòa tan trong nước thì các chất này phân li ra các ion âm và ion dương chuyển động tự do trong dung dịch.
HCl → H+ + Cl–
NaOH → Na+ + OH–
NaCl → Na+ + Cl–
Các dung dịch ancol etylic, saccarozơ, glixerol không dẫn điện được vì khi hòa tan trong nước không phân li ra ion âm và ion dương.
Bài 2 trang 7
Sự điện li, chất điện li là gì ?
Những loại chất nào là chất điện li ? Thế nào là chất điện li mạnh, chất điện li yếu ?
Lấy thí dụ và viết phương trình điện li của chúng.
Bài giải:
– Quá trình phân li các chất trong nước ra ion là sự điện li.
– Chất điện li là những chất khi tan trong nước phân li ra ion.
– Axit, bazơ, muối đều là những chất điện li.
– Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li hoàn toàn ra ion.
H2SO4 → 2H+ + SO42-
KOH → K+ + OH–
Na2SO4 → 2Na+ + SO42-
– Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
H2S ⇌ H+ + HS–
CH3COOH ⇌ CH3COO– + H+
Bài 3 trang 7
Viết phương trình điện li của những chất sau:
a) Các chất điện li mạnh: Ba(NO3)2 0,10 M; HNO3 0,020 M; KOH 0,010 M.
Tính nồng độ mol của từng ion trong các dung dịch trên.
b) Các chất điện li yếu: HClO; HNO2.
Bài giải:
a) Các chất điện li mạnh phân li hoàn toàn nên phương trình điện li và nồng độ các ion trong dung dịch như sau:
Ba(NO3)2 → Ba2+ + 2NO–3
0,10M 0,10M 0,20M
HNO3 → H+ + NO–3
0,020M 0,020M 0,020M
KOH → K+ + OH–
0,010M 0,010M 0,010M
b) Các chất điện li yếu phân li không hoàn toàn nên phương trình điện li như sau:
KOH ⇌ K+ + OH–
HNO2 ⇌ H+ + NO–2
Bài 4 trang 7
Chọn câu trả lời đúng trong các câu sau đây:
Dung dịch chất điện li dẫn điện được là do
A. sự chuyển dịch của các electron.
B. sự chuyển dịch của các cation.
C. sự chuyển dịch của các phân tử hòa tan.
D. sự chuyển dịch của cả cation và anion.
Bài giải:
Dung dịch chất điện li dẫn điện được do sự chuyển dịch của cả cation và anion.
⇒ Chọn đáp án D.
Bài 5 trang 7
Chất nào sau đây không dẫn điện được ?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr hòa tan trong nước.
Bài giải:
KCl rắn, khan tồn tại dưới dạng mạng tinh thể ion, rất bền vững. Không phân li ra được ion dương và ion âm (di chuyển tự do). Vì vậy, KCl rắn, khan không dẫn điện.
⇒ Chọn đáp án A.
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 11 bài 1:
Bài 1.1 trang 3
Các dung dịch sau đây có cùng nồng độ 0,1 mol/l, dung dịch nào dẫn điện kém nhất ?
A. HCl. B. HF.
C. HI. D. HBr.
Bài giải:
Độ dẫn điện tỉ lệ thuận với khả năng phân li ra ion của chất.
Trong 4 chất trên HF có độ dài liên kết ngắn nhất.
⇒ Khả năng phân li ra ion là thấp nhất.
⇒ Độ dẫn điện kém nhất.
⇒ Chọn đáp án B.
Bài 1.2 trang 3
Dung dịch nào dưới đây dẫn điện tốt nhất ?
A. NaI 2.10−3M. B. NaI 1.10−2M.
C. NaI 1.10−1M. D. NaI 1.10−3M.
Bài giải:
Độ dẫn điện tỉ lệ thuận với nồng độ.
Nồng độ càng cao dung dịch dẫn điện càng tốt.
⇒ Chọn đáp án C.
Bài 1.3 trang 3
Trong bốn chất sau, chất nào là chất điện li yếu?
A. H2O B. HCl
C. NaOH D. NaCl
Bài giải:
HCl, NaOH, NaCl là chất điện li mạnh.
H2O là chất điện li yếu.
⇒ Chọn đáp án A.
Bài 1.4 trang 3
Giải thích tại sao khả năng dẫn điện của nước vôi trong (dung dịch Ca(OH)2 trong nước) để trong không khí giảm dần theo thời gian.
Bài giải:
Vì Ca(OH)2 hấp thụ CO2 trong không khí tạo thành kết tủa CaCO3 và H2O làm giảm nồng độ các ion trong dung dịch :
Ca2+ + 2OH– + CO2 → CaCO3 ↓ + H2O
Bài 1.5 trang 3
Viết phương trình điện li của các chất sau trong dung dịch :
1. Các chất điện li mạnh : BeF2, HBrO4, K2CrO4.
2. Các chất điện li yếu : HBrO, HCN.
Bài giải:
1. Phương trình các chất điện li mạnh :
BeF2 → Be2+ +2F−
HBrO4 → H+ + BrO4–
K2CrO4 → 2K+ + CrO42−
2. Phương trình các chất điện li yếu :
HBrO ⇌ H+ + BrO−
HCN ⇌ H+ + CN−
Bài 1.6 trang 3
Viết phương trình điện li của axit yếu CH3COOH trong dung dịch. Nếu hoà tan ít tinh thể chất điện li mạnh CH3COONa vào dung dịch axit trên thì nồng độ H+ tăng hay giảm ? Giải thích dựa vào nguyên lí chuyển dịch cân bằng Lơ Satơliê.
Bài giải:
CH3COOH ⇌ CH3COO− + H+ (1)
CH3COONa phân li trong dung dịch như sau :
CH3COONa ⇌ CH3COO− + Na+ (2)
Sự phân li của CH3COOH là quá trình thuận nghịch. Đây là cân bằng động. Khi hoà tan CH3COONa vào thì nồng độ CH3COO− tăng lên, làm cho cân bằng (1) chuyển dịch từ phải sang trái, nên nồng độ H+ giảm xuống.
Bài 1.7 trang 3
Trong dung dịch CH3COOH 4,3.10-2 M, người ta xác định được nồng độ H+ bằng 8,6.10-4 mol/l. Hỏi có bao nhiêu phần trăm phân tử CH3COOH trong dung dịch này điện li ra ion ?
Bài giải:
Phương trình điện li :
CH3COOH ⇌ CH3COO– + H+
Nồng độ mol ban đầu (M) :
4,3.10-2 0 0
Nồng độ cân bằng (mol/l):
(4,3.10-2 – 8,6.10-4) 8,6.10-4 8,6.10-4
Phần trăm phân tử CH3COOH phân li ra ion :
(8,6.10-4 / 4,3.10-2) x 100% = 2%
Đây là nội dung tóm tắt và giải bài tập Chương 1 bài 1: Sự điện li của chương trình hóa học lớp 11 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 11