Tóm tắt và giải hóa lớp 10 bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
Tóm tắt và giải hóa lớp 10 bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 10 bài 8 mà bạn có thể tham khảo để học hóa tốt hơn !

1. Tóm tắt hóa học lớp 10 bài 8:
a) Sự biến đổi tuần hoàn cấu hình electron nguyên tử
– Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một nhóm A đựơc lặp đi lặp lại sau mỗi chu kì. ⇒ Ta nói chúng biến đổi một cách tuần hoàn.
– Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
b) Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A
1. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A :
– Sự giống nhau về cấu hình electron lớp ngoài cùng của nguyên tử là nguyên nhân của sự giống nhau về tính chất hóa học của nguyên tố trong cùng một nhóm A.
– Số thứ tự nhóm = số electron hóa trị = số electron lớp ngoài cùng.
2. Một số nhóm A tiêu biểu :
- Nhóm VIIIA (Nhóm khí hiếm), gồm các nguyên tố: He, Ne, Ar, Kr, Xe, Rn.
– Cấu hình e lớp ngoài cùng chung: ns2np6 (trừ He)
– Hầu hết các khí hiếm không tham gia phản ứng hoá học, tồn tại ở dạng khí, phân tử chỉ 1 nguyên tử.
- Nhóm IA là nhóm khí hiếm, gồm các nguyên tố: Li, Na, K, Rb, Cs, Fr.
– Cấu hình e lớp ngoài cùng chung: ns1 ⇒ Dễ nhường 1 electron để đạt cấu trúc bền vững của khí hiếm.
– Tính chất hoá học :
+ Tác dụng với oxi tạo oxít bazơ
+ Tác dụng với phi kim tạo muối
+ Tác dụng với nước tạo hiđroxít + H2
- Nhóm VIIA (Nhóm Halogen), gồm các nguyên tố: F, Cl, Br, I, At.
– Cấu hình e lớp ngoài cùng chung: ns2np5 ⇒ Dễ nhận 1 electron để đạt cấu trúc bền vững của khí hiếm.
– Tính chất hoá học :
+ Tác dụng với oxi tạo oxít axít
+ Tác dụng với kim loại tạo muối
+ Tác dụng với H2 tạo hợp chất khí.
2. Hướng dẫn giải bài tập Hóa học 10 bài 8:
Bài 1 trang 41
Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có
A. số electron như nhau
B. số lớp electron như nhau
C. số electron thuộc lớp ngoài cùng như nhau.
D. cùng số electron s hay p.
Chọn đáp án đúng.
Bài giải :
Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có số lớp electron lớp ngoài cùng là như nhau.
⇒ Chọn đáp án C.
Bài 2 trang 41
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau được lặp lại tương tự như chu kì trước là do:
A. Sự lặp lại tính chất kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
B. Sự lặp lại tính chất phi kim của các nguyên tố ở chu kì sau so với chu kì trước.
C. Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước (ở ba chu kì đầu).
D. Sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước.
Chọn đáp án đúng.
Bài giải :
Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước vì có sự biến đổi electron lớp ngoài cùng của nguyên tử các nguyên tố chu kì sau giống như chu kì trước khi điện tích hạt nhân tăng dần.
⇒ Chọn đáp án C.
Bài 3 trang 41
Những nguyên tố thuộc nhóm A nào là các nguyên tố s, nguyên tố p ? Số electron thuộc lớp ngoài cùng trong nguyên tử của các nguyên tố s và p khác nhau thế nào ?
Bài giải :
– Các electron hóa trị của các nguyên tố thuộc nhóm IA, IIA là electron s. Các nguyên tố đó được gọi là nguyên tố s.
– Các electron hóa trị của các nguyên tố thuộc nhóm IIIA, IVA, VA, VIA, VIIA, VIIIA là các electron s và p. Các nguyên tố đó được gọi là nguyên tố p.
– Số electron thuộc lớp ngoài cùng trong nguyên tử của các nguyên tố s là 1 và 2. Số electron thuộc lớp ngoài cùng trong nguyên tử của các nguyên tố p là 3, 4, 5, 6, 7, 8.
Bài 4 trang 41
Những nguyên tố nào đứng đầu các chu kì ? Cấu hình electron nguyên tử của các nguyên tố đó có đặc điểm chung gì ?
Bài giải :
– Những nguyên tố kim loại kiềm đứng đầu chu kì (trừ chu kì 1, hiđro không phải là kim loại)
– Cấu hình electron của nguyên tử các nguyên tố kim loại kiềm có 1 electron lớp ngoài cùng.
Bài 5 trang 41
Những nguyên tố nào đứng cuối các chu kì ? Cấu hình electron của nguyên tử của các nguyên tố đó có đặc điểm chung gì ?
Bài giải :
– Những nguyên tố khí hiếm đứng cuối chu kì.
– Cấu hình electron của nguyên tử các nguyên tố khí hiếm có 8 electron ở lớp ngoài cùng (riêng He có 2e).
Bài 6 trang 41
Một nguyên tố ở chu kì 3, nhóm VIA trong bảng tuần hoàn các nguyên tố hóa học. Hỏi:
a) Nguyên tử của nguyên tố đó có bao nhiêu electron ở lớp electron ngoài cùng ?
b) Các electron ngoài cùng nằm ở lớp electron thứ mấy ?
c) Viết cấu hình electron nguyên tử của nguyên tố trên.
Bài giải :
a) Nguyên tố nằm ở nhóm VIA nên nguyên tử của nguyên tố có 6 electron ở lớp ngoài cùng.
b) Nguyên tố nằm ở chu kì 3 nên các electron ngoài cùng nằm ở lớp thứ ba.
c) Cấu hình electron của nguyên tố : 1s22s22p63s23p4.
Bài 7 trang 41
Một số nguyên tố có cấu hình electron của nguyên tử như sau :
1s22s22p4 1s22s22p3
1s22s22p63s23p1 1s22s22p63s23p5.
a) Hãy xác định số electron hóa trị của từng nguyên tử.
b) Hãy xác định vị trí của chúng (chu kì, nhóm) trong bảng tuần hoàn các nguyên tố hóa học.
Bài giải :
a) Số electron hóa trị của từng nguyên tử :
– 1s22s22p4: Số electron hóa trị là 6.
– 1s22s22p3 : Số electron hóa trị là 5.
– 1s22s22p63s23p1 : Số electron hóa trị là 3.
– 1s22s22p63s23p5 : Số electron hóa trị là 7.
b) Vị trí (chu kì, nhóm) trong bảng tuần hoàn :
– 1s22s22p4 : Nguyên tố thuộc chu kì 2 nhóm VIA.
– 1s22s22p3 : Nguyên tố thuộc chu kì 2 nhóm VA.
– 1s22s22p63s23p1 : Nguyên tố thuộc chu kì 3 nhóm IIIA.
– 1s22s22p63s23p5 : Nguyên tố thuộc chu kì 3 nhóm VIIA.
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 10 bài 8:
Bài 8.1 trang 19
Nguyên tố X có số thứ tự Z = 8.
a) Nguyên tử của nguyên tố X có cấu hình electron là
A. 1s22s22p3 B. 1s22s12p5
C. 1s12s22p5 D. 1s22s22p4
b) Nguyên tố X thuộc chu kì
A. 1. B. 2.
C. 3 D. 4.
c) Nguyên tố X thuộc nhóm
A. IA. B. IIA.
C. VIA. D. IVA.
Bài giải :
a) Chọn đáp án D.
b) Chọn đáp án B.
c) Chọn đáo án C.
Bài 8.2 trang 19
Nguyên tố X thuộc chu kì 3, nhóm IIA. Nguyên tử của nguyên tố X có cấu hình electrọn là
A. 1s22s22p63s1 B. 1s22s22p6
C. 1s22s22p53p4 D. 1s22s22p63s2
Bài giải :
X thuộc chu kì 3 nên có 3 lớp e, X thuộc nhóm IIA nên có 2e hóa trị.
Cấu hình của X: 1s22s22p63s2
⇒ Chọn đáp án D.
Bài 8.3 trang 19
Nguyên tử của nguyên tố X có cấu hình electron : 1s22s22p63s23p3
Hãy chọn câu phát biểu đúng :
a) Số electron lớp ngoài cùng của X là
A. 3. B. 2.
C. 6. D. 5.
b) X thuộc chu kì
A. 1. B. 2.
C.3. D. 4.
c) X thuộc nhóm
A. IA. B. VA.
C. IIIA. D. IVA.
Bài giải :
a) Chọn đáp án D.
b) Chọn đáp án C.
c) Chọn đáo án B.
Bài 8.4 trang 19
Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là: 1s22s22p63s1 ; 1s22s22p63s2 ; 1s22s22p63p1 Dãy gồm các kim loại xếp theo thứ tự tăng dần tính khử là
A. X, Y, Z. B. Z, X, Y.
C. Z, Y, X. D. Y, Z, X.
Bài giải :
X thuộc ô số 11, chu kì 3, nhóm IA
Y thuộc ô số 12, chu kì 3 nhóm IIA
Z thuộc ô số 13 chu kì 3 nhóm IIIA
⇒ Các nguyên tố thuộc cùng một chu kì thì tính khử giảm theo chiều tăng ĐTHN.
⇒ Chọn đáp án C.
Bài 8.5 trang 19
Cho các nguyên tố : K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là
A. N, Si, Mg, K. B. K, Mg, Si, N.
C. K, Mg, N, Si. D. Mg, K, Si, N.
Bài giải :
N (Z = 7) thuộc ô số 7 chu kì 2 nhóm VA.
Mg (Z = 12) thuộc ô số 12, chu kì 3 nhóm IIA.
Si (Z = 14) thuộc ô số 14, chu kì 3 nhóm IVA.
K (Z = 19) thuộc ô số 19 chu kì 4 nhóm IA.
Trong một chu kì, theo chiều tăng ĐTHN bán kính giảm dần.
Trong một nhóm , theo chiều tăng ĐTHN bán kính tăng dần.
⇒ Thứ tự bán kính tăng dần: N, Si, Mg, K
⇒ Chọn đáp án B.
Bài 8.6 trang 20
Cấu hình electron lớp ngoài cùng của một nguyên tố là 2s1 số hiệu nguyên tử của nguyên tố đó là
A. 2. B. 3.
C. 4. D. 5.
Bài giải :
Lớp ngoài cùng là 2s1 thì lớp bên trong là 1s2 ⇒ Z = 3
⇒ Chọn đáp án B.
Bài 8.7 trang 20
Cấu hình electron lớp ngoài cùng của nguyên tử một nguyên tố là 2s22p5, số hiệu nguyên tố đó là
A. 2. B. 5.
C. 7. D. 9.
Bài giải :
Lớp ngoài cùng là 2s22p5 thì lớp bên trong là 1s2 ⇒ Z = 9
⇒ Chọn đáp án D.
Bài 8.8 trang 20
Cấu hình electron lớp ngoài cùng của nguyên tử một nguyên tố là 3s23p1, số hiệu nguyên tử của nguyên tố đó là
A. 10 B. 11
C. 12 D.13
Bài giải :
Lớp ngoài cùng là 3s23p1 thì lớp bên trong là 1s22s22p6 ⇒ Z = 13
⇒ Chọn đáp án D.
Bài 8.9 trang 20
Đối với các nguyên tố thuộc các nhóm A thì những electron của lớp nào trong nguyên tử quyết định tính chất hoá học của nguyên tố đó ? Các electron ở lớp ngoài cùng có phải là các electron hoá trị không ? Hãy cho một thí dụ.
Bài giải :
Đối với các nguyên tố thuộc các nhóm A thì những electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tố tương ứng.
Các electron ở lớp ngoài cùng có khả năng, tham gia hình thành liên kết hoá học được gọi là các electron hoá trị.
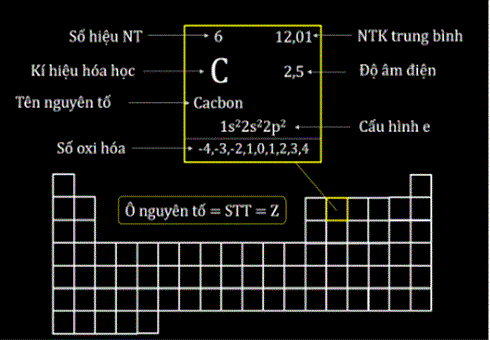
Thí dụ, cacbon có cấu hình electron :1s22s22p2, các electron 2s22p2 là những electron lớp ngoài cùng và là những electron hoá trị.
Bài 8.10 trang 20
Hãy cho biết quan hệ giữa số thứ tự của các nhóm A và số electron ở lớp ngoài cùng của các nguyên tử trong nhóm.
Nitơ (N) thuộc chu kì 2, nhóm VA, hãy viết cấu hình electron của lớp ngoài cùng.
Bài giải :
Đối với các nguyên tố thuộc các nhóm A thì số thứ tự của nhóm (I, II,…) cho biết số electron ở lớp ngoài cùng của các nguyên tử trong nhóm (trừ He). Nitơ thuộc chu kì 2, có hai lớp electron, lớp ngoài là lớp L (n = 2). Vì nitơ thuộc nhóm VA nên số electron ở lớp ngoài cùng là 5.
Cấu hình electron của lớp ngoài cùng của nguyên tử N : 2s22p3
Bài 8.11 trang 20
Heli (He) chỉ có 2 electron ở lớp ngoài cùng, tại sao heli lại được xếp vào nhóm VIIIA ?
Bài giải :
Heli thuộc chu kì 1, ở trạng thái cơ bản, nguyên tử heli chỉ có một lớp electron, đó là lớp K (n = 1), lớp K cũng chính là lớp electron ngoài cùng. Vì lớp K chỉ có tối đa 2(2.12) electron nên với 2 electron lớp này đã bão hoà. Nguyên tử có lớp ngoài bão hoà là nguyên tử rất bền, khó tham gia các phản ứng hoá học. Vì vậy heli được xếp vào nhóm VIIIA cùng với các khí hiếm khác cũng có lớp electron ngoài cùng vững bền.
Bài 8.12 trang 21
Viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc nhóm VIIIA (He, Ne, Ar, Kr, Xe, Rn).
Hãy cho biết đặc điểm về cấu hình electron lớp ngoài cùng của các nguyên tử trên và từ đó cho biết đặc điểm về tính chất của các nguyên tố tương ứng.
Bài giải :
Cấu hình electron lớp ngoài cùng :
He: 1s2
Ne: 2s22p6
Ar: 3s23p6
Kr: 4s24p6
Xe: 5s25p6
Rn: 6s26p6
Nguyên tử của các nguyên tố trong nhóm (trừ heli) đều có 8 electron ở lớp ngoài cùng với cấu hình ns2np6. Đó là cấu hình electron vững bền. He có cấu hình 1s2, nhưng với cấu hình đó, lớp electron ngoài cùng đã bão hoà nên He cũng là một nguyên tử vững bền.
Các nguyên tố thuộc nhóm VIIIA được gọi là các khí hiếm. Các khí hiếm đều khó tham gia các phản ứng hoá học. Ở điều kiện thường, các nguyên tử không liên kết với nhau tạo thành phân tử. ở điều kiện thường, các khí hiếm đều ở trạng thái khí, phân tán.
Bài 8.13 trang 21
Viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc nhóm IA (H, Li, Na, K, Rb, Cs, Fr).
Hãy cho biết đặc điểm về cấu hình electron lớp ngoài cùng của các nguyên tử trên và từ đó cho biết đặc điểm về tính chất của các nguyên tố tương ứng.
Bài giải :
Cấu hình electron lớp ngoài cùng :
H: 1s1
Li: 2s1
Na: 3s1
K: 4s1
Rb: 5s1
Cs: 6s1
Fr: 7s1
Nguyên tử của các nguyên tố thuộc nhóm IA chỉ có 1 electron ở lớp ngoài cùng trên phân lớp s (ns1). Trừ hiđro, còn các nguyên tố khác đều có tên là kim loại kiềm. Vì chỉ có 1 electron ở lớp ngoài cùng nên trong các phản ứng hoá học, nguyên tử của các kim loại kiềm có khuynh hướng nhường đi 1 electron để đạt được cấu hình vững bền của các khí hiếm đứng trước. Do đó, các kim loại kiềm chỉ có hoá trị 1.
Bài 8.14 trang 21
Viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc . nhóm VIIA : flo (F), clo (Cl), brom (Br), iot (I), atatin (At).
Hãy cho biết đặc điểm về cấu hình electron lớp ngoài cùng của các nguyên tử trên và từ đó cho biết đặc điểm về tính chất của các nguyên tố tương ứng.
Bài giải :
Cấu hình electron lớp ngoài cùng :
F: 2s22p5
Cl: 3s23p5
Br: 4s24p5
I: 5s25p5
At: 6s26p5
Nguyên tử của các nguyên tố thuộc nhóm VIIA có 7 electron ở lớp ngoài cùng với cấu hình ns2sp5
Vì chỉ kém khí hiếm đứng sau 1 electron nên trong các phản ứng hoá học, các nguyên tử có khuynh hướng thu thêm 1 electron để đạt được cấu hình vững bền của các khí hiếm đứng sau. Do đó, trong các hợp chất với nguyên tố kim loại, các nguyên tố thuộc nhóm VIIA có hoá trị 1.
Bài 8.15 trang 21
Hãy cho biết nguyên nhân sự biến đổi tuần hoàn tính chất của các nguyên tố.
Bài giải :
Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố.
Bài 8.16 trang 21
guyên tử của nguyên tố X có cấu hình electron : 1s22s22p6
Hãy cho biết số thứ tự của nguyên tố X. Trong bảng tuần hoàn, X thuộc chu kì thứ mấy và thuộc nhóm nào ? Các nguyên tố thuộc nhóm này có tên chung là gì ?
Bài giải :
Ứng với cấu hình 1s22s22p6 nguyên tử có 10 electron, vậy số thứ tự Z = 10. Nguyên tử có 2 lớp electron (lớp K và lớp L), vậy nguyên tố đó thuộc chu kì 2. Lớp ngoài cùng có 8 electron (2s22p6, vậy nguyên tố đó thuộc nhóm VIIIA, các nguyên tố thuộc nhóm này có tên chung là các khí hiếm.
Bài 8.17 trang 21
Một nguyên tố có số thứ tự z = 11.
Hãy viết cấu hình electron nguyên tử của nguyên tố đó và từ cấu hình electron hãy cho biết nguyên tố đó thuộc chu kì thứ mấy và thuộc nhóm nào ? Các nguyên tố thuộc nhóm này có tên chung là gì ?
Bài giải :
Ứng với Z = 11, nguyên tử có 11 electron, do đó có cấu hình electron : 1s22s22p63s1
Nguyên tử có 3 lớp electron (lớp K, L, M), vậy nguyên tố đó thuộc chu kì 3. Lớp ngoài cùng có 1 electron, vậy nguyên tố đó thuộc nhóm IA. Các nguyên tố thuộc nhóm này (trừ hiđro) có tên chung là các kim loại kiềm.
Đây là nội dung tóm tắt và giải bài tập Chương 2 bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học của chương trình hóa học lớp 10 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 10
We on social :