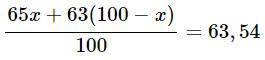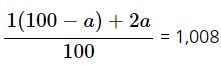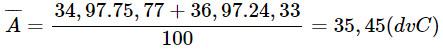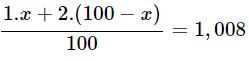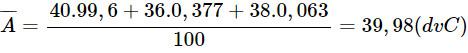Tóm tắt và giải hóa lớp 10 bài 2: Hạt nhân nguyên tử – Nguyên tố hóa học – Đồng vị
Tóm tắt và giải hóa lớp 10 bài 2: Hạt nhân nguyên tử – Nguyên tố hóa học – Đồng vị
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 10 bài 2 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 10 bài 2:
a) Hạt nhân nguyên tử :
- Điện tích hạt nhân:
– Proton mang điện tích 1+, nếu có Z proton thì điện tích của hạt nhân bằng Z+ và số đơn vị điện tích hạt nhân bằng Z.
– Nguyên tử trung hoà về điện nên số proton trong hạt nhân bằng số electron của nguyên tử.
Số đơn vị điện tích hạt nhân Z = số proton = số electron
- Số khối:
– Số khối (kí hiệu là A) là tổng số hạt proton (kí hiệu là Z) và tổng số hạt nơtron (kí hiệu là N) của hạt nhân đó :
A = Z + N
– Số đơn vị điện tích hạt nhân Z và số khối A đặc trưng cho hạt nhân và cũng đặc trưng cho nguyên tử.
b) Nguyên tố hóa học :
– Nguyên tố hoá học là những nguyên tử có cùng điện tích hạt nhân.
– Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử của nguyên tố đó, kí hiệu là Z.
– Kí hiệu nguyên tử :
Trong đó:
X: Nguyên tố hóa học
A: Số khối của nguyên tố X
Z: Số đơn vị điện tích hạt nhân của nguyên tố X
c) Đồng vị :
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó số khối A của chúng khác nhau.
d) Nguyên tử khối và nguyên tử khối trung bình của các nguyên tố hóa học :
Nguyên tử khối:
– Nguyên tử khối là khối lượng tương đối của nguyên tử.
– Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
– Khối lượng của nguyên tử coi như bằng tổng khối lượng của các proton và nơtron trong hạt nhân nguyên tử.
– Nguyên tử khối coi như bằng số khối (khi không cần độ chính xác cao).
Nguyên tử khối trung bình:
Công thức tính nguyên tử khối trung bình Ā :
Ā = (aX + bY) / 100
2. Hướng dẫn giải bài tập Hóa học 10 bài 2:
Bài 1 trang 13
Nguyên tố hoá học là những nguyên tử có cùng
A. số khối. C. số proton.
B. số nơtron. D. số nơtron và số proton.
Chọn đáp án đúng.
Bài giải :
Chọn đáp án C.
Bài 2 trang 13
Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết
A. số khối A. B. số hiệu nguyên tử Z.
C. nguyên tử khối của nguyên tử. D. số khối A và số hiệu nguyên tử Z.
Chọn đáp án đúng.
Bài giải :
Chọn đáp án D.
Bài 3 trang 14
Nguyên tố cacbon có hai đồng vị : chiếm 98,89% và chiếm 1,11%.
Nguyên tử khối trung bình của cacbon là
a) 12,500 b) 12,011 c) 12,022 d) 12,055
Chọn đáp số đúng.
Bài giải :
Ta có : Ā = (aX + bY) / 100
→ Ā = (12 x 98,89 + 13 x 1,11) / 100 = 12,011
⇒ Chọn đáp án B.
Bài 4 trang 14
Hãy xác định điện tích hạt nhân, số proton, số nơtron, số electron, nguyên tử khối của các nguyên tử thuộc các nguyên tố sau:
Bài giải :
| Nguyên tố | Điện tích hạt nhân | Số proton | Số nơtron | Số electron | Nguyên tử khối |
| 3+ | 3 | 7 – 3 = 4 | 3 | 7 | |
| 9+ | 9 | 19 – 9 = 10 | 9 | 19 | |
| 12+ | 12 | 24 – 12 = 12 | 12 | 24 | |
| 20+ | 20 | 40 – 20 = 20 | 20 | 40 |
Bài 5 trang 14
Đồng có hai đồng vị và
. Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm của mỗi đồng vị.
Bài giải :
Gọi x là thành phần % của đồng vị
Ta có :
Nguyên tử khối trung bình của đồng là :
⇔ 65x + 63(100 – x) = 6354
⇔ 65x + 6300 – 63x = 6354
⇔ 2x = 54
⇔ x = 27
Vậy thành phần phần trăm của là 27%,
là 100% – 27% = 73%.
Bài 6 trang 14
Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị trong 1ml nước (cho rằng trong nước chỉ có đồng vị
và
)? (Cho khối lượng riêng của nước là 1 g/ml).
Bài giải :
Gọi % số nguyên tử đồng vị là a% :
⇒ a = 0,8
Ta có : khối lượng của 1 ml nước là 1 gam.
Phân tử khối của nước là :
MH2O = 2.1,008 + 16 = 18,016u
Khối lượng của 1 mol H2O là 18,016 g
Số mol của 1 gam nước là :
1/18,016 = 0,0555 (mol)
Số nguyên tử H có trong 1 ml H2O :
2.0,0555.6,022.1023 = 6,68442.1022 nguyên tử
Số nguyên tử trong 1 ml H2O là :
6,68442.1022 x (0,8/100) = 5,35.1020 nguyên tử.
Bài 7 trang 14
Oxi tự nhiên là một hỗn hợp các đồng vị : 99,757% 16O; 0,039% 17O; 0,204% 18O. Tính số nguyên tử của mỗi loại đồng vị khi có 1 nguyên tử 17O.
Bài giải :
Khi có 1 nguyên tử 17O, mà % nguyên tử của 17O = 0,039%
⇒ Số nguyên tử O = 1 : 0,039% ≈ 2564 nguyên tử
Số nguyên tử của mỗi loại đồng vị khi có 1 nguyên tử 17O là :
99,757% 16O ⇒ Số nguyên tử 16O = 99,757% x 2564 = 2558 nguyên tử
0,204% 18O ⇒ Số nguyên tử 18O = 0,204% x 2564 = 5 nguyên tử
Bài 8 trang 14
Agon tách ra từ không khí là hỗn hợp ba đồng vị: 99,6% 40Ar; 0,063% 38Ar; 0,337% 36Ar. Tính thể tích của 10 g Ar ở điều kiện tiêu chuẩn.
Bài giải :
Nguyên tử khối trung bình là :
Ta có :
22,4 lít Ar ở đktc có khối lượng 39,985 g
a lít Ar ở đktc có khối lượng 10 g
⇒ a = (10 x 22,4) / 39,985 = 5,602 lít
Vậy thể tích của 10 g Ar là 5,602 lít.
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 10 bài 2:
Bài 2.1 trang 5
Ba nguyên tử X, Y, Z có số proton và số nơtron như sau :
X : 20 proton và 20 nơtron,
Y: 18 proton và 22 nơtron,
Z : 20 proton và 22 nơtron.
a) Những nguyên tử là các đồng vị của cùng một nguyên tố là
A. X, Y. B. X, Z.
C. Y, Z. D. X, Y, Z.
b) Những nguyên tử có cùng số khối là
A. X, Y. B. X, Z
C. Y, Z. D. X, Y, Z.
Bài giải :
a) Chọn đáp án B.
b) Ta có :
AX = 20 + 20 = 40
AY = 18 + 22 = 40
AZ = 20 + 22 = 42
⇒ Chọn đáp án A.
Bài 2.2 trang 5
Cacbon tự nhiên là hỗn hợp của hai đồng vị 12C và 12C, trong đó đồng vị 12C chiếm 98,9%.
Biết rằng đồng vị 12C có nguyên tử khối bằng 13,0034, đồng vị 12C có nguyên tử khối bằng 12, nguyên tử khối trung bình của cacbon là
A. 12,150. B. 12,011.
C. 12,512. D. 12,250.
Bài giải :
Nguyên tử khối trung bình của cacbon là :
⇒ Chọn đáp án B.
Bài 2.3 trang 5
Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hoá học ?
Bài giải :
Chọn đáp án B
Bài 2.4 trang 6
Đồng có 2 đồng vị bền là và
. Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm của đồng vị
.
Bài giải :
Gọi phần trăm khối lượng của là a.
Ta có nguyên tử khối trung bình của đồng là 63,54.
→ x = 73%
Bài 2.5 trang 6
Hãy cho biết số đơn vị điện tích hạt nhân, số proton, số nơtron, số electron và số khối của các nguyên tử sau đây :
2311Na, 136C, 199F, 3517Cl, 4420Ca
Bài giải :
2311Na có Z = số đơn vị điện tích hạt nhân = số proton = số electron = 11, số khối bằng 23, số nơtron bằng 12.
136C có Z = 6, số khối A = 13, số nơtron = 7
199F có Z = 9, số khối A = 19, số nơtron = 10
3517Cl có Z = 17, số khối A = 35, số nơtron = 18
4420Ca có Z = 20, số khối A = 44, số nơtron = 24
Bài 2.6 trang 6
Cho các đồng vị của hiđro 1H; 2H; 3H
a) Đồng vị nào không có nơtron ?
b) Đồng vị nào có số nơtron gấp đôi số proton ?
Bài giải :
a) Đồng vị không có nơtron là : 1H
b) Đồng vị có số nơtron gấp đôi số proton là : 3H
Bài 2.7 trang 6
Khi cho hạt nhân 42He bắn phá vào hạt nhân 147N người ta thu được một proton và một hạt nhân X.
Hỏi số khối A và số đơn vị điện tích hạt nhân z của hạt nhân X và hãy cho biết X là nguyên tố gì ?
Bài giải :
Phản ứng trên có thể viết :
Vì số hạt (proton cũng như số hạt nơtron) được bảo toàn nên :
A = (4 + 14) – 1 = 17
Z = (2 + 7) – 1 = 8
Với Z = 8 nên X là nguyên tử oxi.
Phương trình trên sẽ là :
Thông tin thêm: Chính từ phản ứng này, Rơ – dơ – pho đã phát hiện ra proton, một cấu tử của hạt nhân.
Bài 2.8 trang 6
a) Hãy cho biết khối lượng (tính theo đơn vị khối lượng nguyên tử) và điện tích của nơtron (tính theo điện tích đơn vị).
b) Khi cho hạt nhân 42He bắn phá vào hạt nhân beri 94Be người ta thu được một nơtron và một hạt nhân Y.
Hỏi số khối A và số đơn vị điện tích hạt nhân Z của hạt nhân Y và hãy cho biết Y là nguyên tố gì ?
Bài giải :
a) Nơtron có khối lượng ≈ 1 u, không mang điện tích (nơtron được kí hiệu là 10n).
b) Phản ứng trên có thể viết :
Vì số hạt (proton cũng như số hạt nơtron) được bảo toàn nên :
A = (4 + 9) – 1 = 12
Z = (2 + 4) – 0 = 6
Phương trình trên sẽ là :
Thông tin thêm: Chính từ phản ứng này, Chat – uých đã phát hiện ra nơtron, một cấu tử của hạt nhân.
Bài 2.9 trang 6
Thế nào là cacbon-12 (12C hay 126C) ? Hãy cho biết thành phần cấu tạo của nguyên tử cacbon-12.
Bài giải :
Trong tự nhiên, nguyên tố cacbon có hai đồng vị : 12C (98,9%) và 126C (1,1%). Chính đồng vị 126C đã được chọn làm cơ sở để định nghĩa đơn vị khối lượng nguyên tử, được gọi là cacbon-12 hay 12C
Thành phần cấu tạo của nguyên tử cacbon-12 là :
Với Z = 6 và A = 12, nguyên tử 126C có 6 proton, 6 nơtron ở hạt nhân và electron ở vỏ nguyên tử.
Bài 2.10 trang 6
Khi đưa khối khí đơteri (21H) lên một nhiệt độ cao (hàng triệu độ) thì do va chạm, từng cặp hai hạt nhân (21H) có thể kết hợp với nhau tạo thành hạt nhân mới (phản ứng nhiệt hạch).
Hỏi số khối, số đơn vị điện tích hạt nhân của hạt nhân mới được hĩnh thành và hãy cho biết đó là hạt nhân của nguyên tử gì ?
Bài giải :
Mỗi hạt nhân đơteri 21H có 1 proton và 1 nơtron : A = 2 và Z = 1.
Hạt nhân mới hình thành có số đơn vị điện tích và số khối là :
Z = 1 + 1 = 2
A = 2 + 2 = 4
Đó là hạt nhân heli vì z = 2 đặc trưng cho nguyên tố heli.
Phản ứng tổng hợp hai hạt nhân đơteri được biểu diễn bằng phương trình :
21H + 21H → 42He
Thông tin thêm: Phản ứng này kèm theo hiện tượng hụt khối lượng đáng kể và do đó toả ra nhiều nhiệt, đó là nguyên tắc của bom H.
Bài 2.11 trang 7
Gọi A là số khối của hạt nhân nguyên tử. Bán kính R của hạt nhân được tính gần đúng bằng hệ thức :
Với ro = 1,2.10-13 cm.
Hãy tính khối lượng riêng của hạt nhân và cho biết khối lượng riêng đó có phụ thuộc vào số khối không ? (Coi nguyên tử khối trùng với số khối).
Bài giải :
Thể tích của hạt nhân:
V = 4/3 πR3 = 4/3 π(1,2.10-13)3A (cm3)
Khối lượng m của hạt nhân:
m = A / 6,022.1023 (g)
Khối lượng riêng của hạt nhân :
D ≈ 230 (triệu tấn/cm3)
Ta thấy biểu thức tính khối lượng riêng D không chứa số khối A (sau khi đã làm đơn giản) tức là D không phụ thuộc vào số khối A. Như vậy, theo hệ thức gần đúng nói trên thì khối lượng riêng của mọi hạt nhân đều như nhau.
Bài 2.12 trang 7
Hiđro có các đồng vị: 1H, 2H và oxi có các đồng vị : 16O, 17O, 18O
Hãy viết công thức của các loại phân tử nước khác nhau.
Bài giải :
Công thức của các loại phân tử nước :
1H216O, 2H216O, 1H2H16O
1H217O, 2H217O, 1H2H17O
1H218O, 2H218O, 1H2H18O
Bài 2.13 trang 7
Clo tự nhiên là hỗn hợp của hai đồng vị :
35Cl có nguyên tử khối là 34,97.
37Cl có nguyên tử khối ià 36,97.
Biết rằng đồng vị 35Cl hiếm 75,77% ; hãy tính nguyên tử khối trung bình của clo tự nhiên.
Bài giải :
Nguyên tử khối trung bình của clo tự nhiên :
Bài 2.14 trang 7
Các đồng vị của hiđro tồn tại trong tự nhiên chủ yếu là 21H 11H
Đồng vị thứ ba 31H có thành phần không đáng kể. Coi các đồng vị trên có nguyên tử khối tương ứng là 1 và 2 ; nguyên tử khối trung bình của hiđro tự nhiên là 1,008. Hãy tính thành phần phần trăm số nguyên tử của hai đồng vị 21H 11H.
Bài giải :
Gọi x là thành phần phần trăm của 1H
→ Thành phần phần trăm của 21H sẽ là 100 – x
Ta có :
Giải phương trình ta được x = 99,2
Vậy phần trăm số nguyên tử 11H là 99,2%, 21H là 0,8%.
Bài 2.15 trang 7
Nguyên tử 40Ar và 40Ca có cùng số khối là 40. Vậy chúng có phải là những đồng vị không ?
Bài giải :
Chúng không phải là những đồng vị bởi vì hai nguyên tử này có điện tích hạt nhân khác nhau : 18Ar và 20Ca.
Những nguyên tử có điện tích hạt nhân khác nhau có cùng nguyên tử khối gọi là những đồng lượng.
Bài 2.16 trang 7
Cho các hạt nhân nguyên tử sau đây, cùng với số khối và điện tích hạt nhân :
A(11 ; 5) ; B(23 ; 11) ; C(20 ; 10);
D(21 ; 10) ; E(10 ; 5) ; G(22 ; 10)
+ Ở đây có bao nhiêu nguyên tố hoá học ?
+ Mỗi nguyên tố có bao nhiêu đồng vị ?
+ Mỗi đồng vị có bao nhiêu electron ? Bao nhiêu nơtron ?
Bài giải :
Ở đây có 3 nguyên tố hoá học ở các ô số 5, 10, 11.
– Nguyên tố ở ô số 10 là neon (Z = 10). Neon có 3 đồng vị là :
2010C ; 2110D ; 2210G
Tất cả 3 đồng vị của nguyên tố neon đều có cùng số electron là 10 (bằng số proton) nhưng số nơtron lần lượt là 10, 11, 12.
– Nguyên tố ở ô số 5 là bo (Z = 5). Bo có 2 đồng vị là :
105E ; 115A
Cả 2 đồng vị của nguyên tố bo đều có 5 electron nhưng số nơtron lần lượt là 5 và 6.
– Đồng vị của nguyên tố natri (Z = 11) là :
2311B
Đồng vị này có 11 electron và 12 nơtron.
Bài 2.17 trang 8
Nguyên tố chì có 4 đồng vị 20482Pb (2,5%), 20682Pb (23,7%), 20782Pb (22,4%) còn lại 20882Pb. Tính nguyên tử khối trung bình của chì.
Bài giải :
Phần trăm đồng vị 20882Pb là :
%20882Pb = 100% – (2,5% + 23,7% + 22,4%) = 51,4%
Nguyên tử khối trung bình của chì là :
Bài 2.18 trang 8
Agon tách từ không khí là một hỗn hợp của 3 đồng vị sau :
20Ar (99,6%) 38Ar (0,063%) 36Ar (0,337%)
Tính thể tích của 20 gam agon ở điều kiện tiêu chuẩn.
Bài giải :
Nguyên tử khối trung bình của agon là :
Ở điều kiện tiêu chuẩn, 1 mol agon tức là 39,98 g chiếm thể tích là 22,4 lít.
Vậy thể tích của 20 gam agon là : (22,4 x 20)/39,98 = 11,2 lít
Đây là nội dung tóm tắt và giải bài tập Chương 1 bài 2: Hạt nhân nguyên tử – Nguyên tố hóa học – Đồng vị của chương trình hóa học lớp 10 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 10