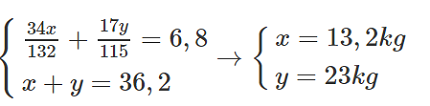Tóm tắt và giải hóa lớp 9 bài 11: Phân bón hóa học
Tóm tắt và giải hóa lớp 9 bài 11: Phân bón hóa học
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 9 bài 11 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 9 bài 11:
a) Phân bón hóa học
– Phân bón hóa học là những hợp chất hóa học chứa các nguyên tố dinh dưỡng, được bón cho cây nhằm nâng cao năng suất cây trồng.
– Các nguyên tố dinh dưỡng cần cho cây trồng như: N, K, P, Ca, Mg, B, Cu, Zn,…
b) Những phân bón hóa học thường dùng
- Phân bón đơn (chỉ chứa một trong ba nguyên tố dinh dưỡng chính là N, P, K)
Phân đạm (chứa N): Một số phân đạm thường dùng là
– Ure CO(NH2)2, tan trong nước, chứa 46% nitơ.
– Amoni nitrat NH4NO3, tan trong nước, chứa 35% nitơ.
– Amoni sunfat (NH4)2SO4, tan trong nước, chứa 21% nitơ.
Phân lân (chứa P): Một số phân lân thường dùng là
– Photphat tự nhiên thành phần chính chứa Ca3(PO4), không tan trong nước, tan chậm trong đất chua.
– Supephotphat, thành phần chính là Ca(H2PO4)2, tan trong nước.
Phân kali (chứa K):
Những phân kali thường dùng là KCl, K2SO4,… đều dễ tan trong nước.
- Phân bón dạng kép (chứa hai hoặc cả ba nguyên tố dinh dưỡng N, P, K)
Phân NPK: chứa {NH4NO3, (NH4)2HPO4 và KCl}.
Phân amophot: chứa {NH4H2PO4 và (NH4)2HPO4}.
- Phân bón vi lượng: chứa một lượng nhỏ các nguyên tố như: bo, kẽm, mangan,…dưới dạng hợp chất.
2. Hướng dẫn giải bài tập Hóa học 9 bài 11:
Bài 1 trang 39
Có những loại phân bón hóa học: KCl, NH4NO3, NH4Cl, (NH4)2SO4, Ca3(PO4)2, Ca(H2PO4)2, (NH4)2HPO4, KNO3.
a) Hãy cho biết tên hóa học của những phân bón nói trên.
b) Hãy sắp xếp những phân bón này thành 2 nhóm phân bón đơn và phân bón kép.
c) Trộn những phân bón nào với nhau ta được phân bón kép NPK ?
Bài giải :
a) Tên hóa học của phân bón :
KCl: Kali clorua
NH4NO3: Amoni nitrat
NH4Cl: Amoni clorua
(NH4)2SO4: Amoni sunphat
Ca3(PO4)2: Canxi photphat
Ca(H2PO4)2: Canxi đihiđrophotphat
(NH4)2HPO4: Điamoni hiđrophotphat
KNO3: Kali nitrat
b) Hai nhóm phân bón :
- Phân bón đơn: KCl, NH4NO3, NH4Cl, (NH4)2SO4, Ca3(PO4)2, Ca(H2PO4)2.
– Phân đạm: NH4NO3 ,NH4Cl, (NH4)2SO4
– Phân lân: Ca3(PO4)2, Ca(H2PO4)2
– Phân kali: KCl
- Phân bón kép: (NH4)2HPO4, KNO3.
c) Phân bón kép NPK :
Trộn các phân bón NH4NO3, (NH4)2HPO4 và KCl theo tỉ lệ thích hợp, được phân bón NPK.
Bài 2 trang 39
Có ba mẫu phân bón hóa học không ghi nhãn là: phân kali KCl, phân đạm NH4NO3 và phân superphotphat (phân lân) Ca(H2PO4)2. Hãy nhận biết mỗi mẫu phân bón trên bằng phương pháp hóa học.
Bài giải :
Trích mẫu thử.
Cho dung dịch Ca(OH)2 vào các ống nghiệm chứa ba mẫu phân bón trên và đun nóng :
- Nếu có khí mùi khai NH3 thoát ra là NH4NO3
2NH4NO3 + Ca(OH) Ca(NO3)2 + 2NH3↑ + 2H2O
- Nếu có kết tủa xuất hiện là Ca(H2PO4)2
2Ca(OH)2 + Ca(H2PO4)2 → Ca3(PO4)2↓ + 4H2O
- Không có hiện tượng là KCl.
Bài 3 trang 39
Một người làm vườn đã dùng 500 g (NH4)2SO4 để bón rau.
a) Nguyên tố dinh dưỡng nào có trong loại phân bón này?
b) Tính thành phần phần trăm của nguyên tố dinh dưỡng trong phân bón.
c) Tính khối lượng của nguyên tố dinh dưỡng bón cho ruộng rau.
Bài giải :
a) Nguyên tố dinh dưỡng cho cây trồng trong phân bón (NH4)2SO4 là nitơ.
b) Giả sử có 1 mol (NH4)2SO4
m(NH4)2SO4 = n(NH4)2SO4 x M(NH4)2SO4 = 1 x 132 = 132 (g)
mN = 2 x 14 x 1 = 28 (g)
Thành phần phần trăm của nguyên tố dinh dưỡng trong phân bón :
%mN = (mN / m(NH4)2SO4) x 100% = (28 / 132) x 100% = 21,21%
c) Khối lượng của nguyên tố dinh dưỡng bón cho ruộng rau :
Trong 132 gam (NH4)2SO4 có 28 gam N
Trong 500 gam (NH4)2SO4 có x gam N
→ x = (28 x 500) / 132 = 106 (g)
Vậy khối lượng của nguyên tố dinh dưỡng bón cho ruộng rau là 106 (g)
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 9 bài 11:
Bài 11.1 trang 14
Ba nguyên tố cơ bản là chất dinh dưỡng cho thực vật, đó là : nitơ (N), photpho (P), kali (K).
Hợp chất của nitơ làm tăng trưởng lá cây và tinh bột trong ngũ cốc. Hợp chất của photpho kích thích bộ rễ phát triển và hoa quả chín sớm.
Hợp chất của kali tăng cường sức chịu đựng cho thực vật.
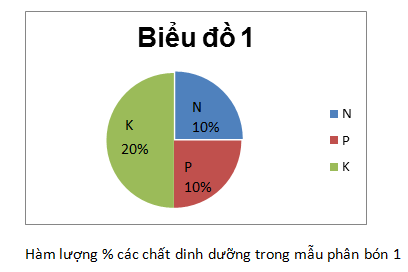
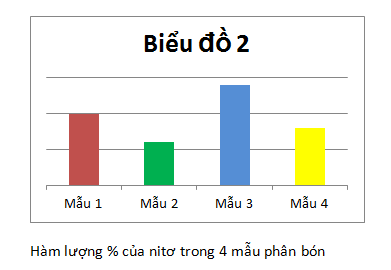
Dưới đây là hàm lượng của N, P, K có trong 4 mẫu phân bón kép NPK :
| MẪU PHÂN BÓN | %N | %P | %K |
| 1 | 10 | 10 | 20 |
| 2 | 6 | 15 | 15 |
| 3 | 14 | 6 | 20 |
| 4 | 8 | 12 | 8 |
Dùng số liệu của bảng, hãy :
a) Vẽ biểu đồ biểu thị chất dinh dưỡng trong mẫu phân bón 1.
b) Vẽ biểu đồ so sánh hàm lượng của nitơ có trong 4 loại phân bón.
c) Giới thiệu mẫu phân bón cho ngô, khoai để có hàm lượng nitơ bằng hàm lượng photpho và có hàm lượng kali cao.
Bài giải :
a) Biểu đồ biểu thị chất dinh dưỡng
b) Biểu đồ so sánh hàm lượng của nitơ
c) Mẫu phân bón số 1.
Bài 11.2 trang 14
Có ba mẫu phân bón hoá học không ghi nhãn là : phân kali KCl, phân đạm NH4NO3 và phân lân Ca(H2PO4)2. Hãy nhận biết mỗi mẫu phân bón trên bằng phương pháp hoá học và viết các phương trình hoá học.
Bài giải :
Lấy một lượng nhỏ mỗi mẫu phân bón vào ống nghiệm. Thêm 4 – 5 ml nước, khuấy kĩ và lọc lấy nước lọc.
– Lấy 1 ml nước lọc của từng loại phân bón vào ống nghiệm. Nhỏ vào mỗi ống vài giọt dung dịch Na2CO3, nếu có kết tủa trắng thì phân bón hoá học đó là Ca(H2PO4)2 :
Na2CO3 + Ca(H2PO4)2 → CaCO3 ↓ + 2NaH2PO4
– Lấy 1 ml nước lọc của hai loại phân bón còn lại, thử bằng dung dịch AgNO3, nếu có kết tủa trắng thì phân bón đó là KCl :
KCl + AgNO3 → AgCl ↓ + KNO3
– Nước lọc nào không có phản ứng hoá học với hai thuốc thử trên là NH4NO3.
Ghi chú : Ngoài ra còn có những phương pháp hoá học khác.
Bài 11.3 trang 14
Trong công nghiệp, người ta điều chế phân đạm urê bằng cách cho khí amoniac NH3 tác dụng với khí cacbon đioxit CO2 :
2NH3 + CO2 → CO(NH2)2 + H2O
Để có thể sản xuất được 6 tấn urê, cần phải dùng
a) Bao nhiêu tấn NH3 và CO2 ?
b) Bao nhiêu m3 khí NH3 và CO2 (đktc) ?
Bài giải :
a) Phương trình hóa học :
2NH3 + CO2 → CO(NH2)2 + H2O
2.17g 44 g 60 g
? tấn ? tấn 6 tấn
mNH3 = (6,2 x 17) / 60 = 3,4 (tấn)
mCO2 = 6,44 / 60 = 4,4 (tấn)
b) Phương trình hóa học :
2NH3 + CO2 → CO(NH2)2 + H2O
Số mol urê là :
nurê = m / M = 6000000/60 = 100000 (mol)
Theo phương trình hóa học, ta có :
nNH3 = 2nure = 2 x 100000 = 200000 (mol)
VNH3 = n x 22,4 = 200000 x 22,4 = 4480000 = 4480 (m3)
Theo phương trình hóa học, ta có :
nCO2 = nurê = 100000 (mol)
VCO2 = 100000 x 22,4 = 2240000 lít = 2240 (m3)
Bài 11.4 trang 15
Điều chế phân đạm amoni nitrat NH4NO3 bằng phản ứng của canxi nitrat Ca(NO3)2 với amoni cacbonat (NH4)2CO3.
a) Viết phương trình hoá học.
b) Phản ứng này thuộc loại phản ứng nào ? Vì sao phản ứng này có thể xảy ra được ?
c) Cần phải dùng bao nhiêu tấn canxi nitrat và amoni cacbonat đế sản xuất được 8 tấn phân đạm amoni nitrat ?
Bài giải :
a) Phương trình hoá học :
Ca(NO3)2 + (NH4)2CO3 → CaCO3 + 2NH4NO3
b) Phản ứng này thuộc loại phản ứng trao đổi giữa hai dung dịch muối. Phản ứng xảy ra được vì tạo thành chất kết tủa là CaCO3.
c) Tính khối lượng các chất tham gia :
Để sản xuất được 80 x 2 = 160 (tấn) NH4NO3 cần 96 tấn (NH4)2CO3 và 164 tấn Ca(NO3)2.
Để sản xuất được 8 tấn NH4NO3 cần :
(96 x 8)/160 = 4,8 tấn (NH4)2CO3
Và (168 x 8)/160 = 8,2 tấn Cu(NO3)2
Bài 11.5 trang 15
Cho 6,8 kg NH3 tác dụng với dung dịch H3PO4 thấy tạo ra 36,2 kg hỗn hợp hai muối NH4H2PO4 và (NH4)2HPO4 theo phương trình hoá học :
2NH3 + H3PO4 → (NH4)2HPO4
NH3 + H3PO4 → (NH4)2HPO4
a) Hãy tính khối lượng axit H3PO4 đã tham gia phản ứng
b) Tính khối lượng mỗi muối được tạo thành.
Bài giải :
a) Theo định luật bảo toàn khối lượng, ta có :
mNH3 + mH3PO4 = mmuối
⇒ mH3PO4 = mmuối – mNH3 = 36,2 – 6,8 = 29,4 (g)
b) Gọi khối lượng muối (NH4)2HPO4 là x kg ⇒ mNH3 phản ứng là 34x/132 (kg)
NH4H2PO4 là y kg ⇒ mNH3 phản ứng là 17y/115 (kg)
Ta có:
Vậy khối lượng của (NH4)2HPO4 là 13,2 kg và NH4H2PO4 là 23 kg.
Đây là nội dung tóm tắt và giải bài tập Chương 1 bài 11: Phân bón hóa học của chương trình hóa học lớp 9 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 9