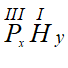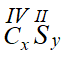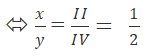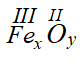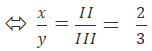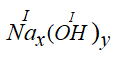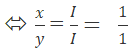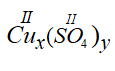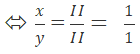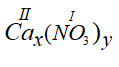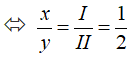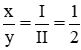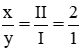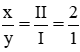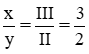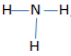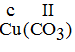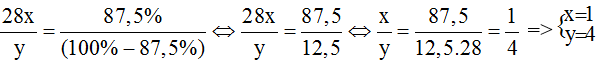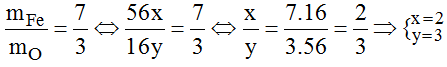Tóm tắt và giải hóa lớp 8 bài 10: Hóa trị
Tóm tắt và giải hóa lớp 8 bài 10: Hóa trị
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 10 mà bạn có thể tham khảo để học hóa tốt hơn!
1. Tóm tắt hóa học lớp 8 bài 10 – Hóa trị:
– Hóa trị là con số biểu diễn khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
– Hóa trị của một nguyên tố được xác định theo hóa trị của H chọn làm đơn vị và hóa trị của O là hai đơn vị.
– Quy tắc: Trong công thức hóa học, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia. ( x.a = y.b )
2. Hướng dẫn giải bài tập Hóa học 8 bài 10 – Hóa trị:
Bài 1 trang 37
a. Hóa trị của một nguyên tố (hay một nhóm nguyên tử) là gì ?
Hóa trị của nguyên tố (hay nhóm nguyên tử) là con số biểu thị khả năng liên kết của nguyên tử (hay nhóm nguyên tử).
b. Khi xác định hóa trị, lấy hóa trị của nguyên tố nào làm đơn vị, nguyên tố nào là hai đơn vị ?
Khi xác định hóa trị lấy hóa trị của H làm đơn vị và hóa trị của O là hai đơn vị.
Bài 2 trang 37
Hãy xác định hóa trị của mỗi nguyên tố trong các hợp chất sau đây :
a) KH, H2S, CH4.
– KH: Gọi a là hóa trị của K
Theo quy tắc hóa trị ta có:
KaHI ⇒ 1.a = 1.I ⇒ a = I
Vậy hóa trị của K là I
– H2S: Gọi b là hóa trị của S
Theo quy tắc hóa trị ta có:
HI2Sb ⇒ 2.I = 1.b ⇒ b = II
Vậy hóa trị của S là II
– CH4: Gọi c là hóa trị của C
Theo quy tắc hóa trị ta có:
CcHI4 ⇒ 1.c = I.4 ⇒ c = IV
Vậy hóa trị của C là IV
b) FeO, Ag2O, SiO2.
– FeO: Gọi d là hóa trị của Fe
Theo quy tắc hóa trị ta có:
FedOII ⇒ 1.d = 1.II ⇒ d = II
Vậy hóa trị của Fe là II
– Ag2O: Gọi e là hóa trị của Ag
Theo quy tắc hóa trị ta có:
Age2OII ⇒ 2.e = 1.II ⇒ e = I
Vậy hóa trị của Ag là I
– SiO2: Gọi g là hóa trị của Si
Theo quy tắc hóa trị ta có:
SIgOII2⇒ 1.g = 2.II ⇒ g = IV
Vậy hóa trị của Si là IV
Bài 3 trang 37
a) Nêu quy tắc hóa trị với hợp chất hai nguyên tố. Lấy công thức hóa học của hai hợp chất trong câu trên làm thí dụ.
Quy tắc hóa trị với hợp chất hai nguyên tố: Trong công thức hóa học, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
Thí dụ:
FeO : Fe hóa trị II, oxi cũng hóa trị II ⇒ II.1 = 1.II
SiO2 : Si hóa trị IV, oxi hóa trị II ⇒ IV.1 = II.2
b) Biết công thức hóa học K2SO4, trong đó K hóa trị I, nhóm (SO4) hóa trị II. Hãy chỉ ra công thức hóa học trên là công thức phù hợp đúng theo quy tắc hóa trị.
Công thức hóa học K2SO4, K có chỉ số là 2, hóa trị I; nhóm (SO4) có chỉ số là 1, hóa trị II. Theo quy tắc hóa trị ta có:
I.2 = II.1
⇒ Công thức K2SO4 là công thức phù hợp với quy tắc hóa trị.
Bài 4 trang 38
a) Tính hóa trị của mỗi nguyên tố trong các hợp chất sau, biết Cl hóa trị I: ZnCl2, CuCl, AlCl3.
Bài giải:
– ZnCl2: Gọi a là hóa trị của Zn
Theo quy tắc hóa trị ta có: 1.a = 2.I => a = II.
Vậy Zn có hóa trị II
– CuCl: Gọi b là hóa trị của Cu
Theo quy tắc hóa trị ta có: 1.b = 1.I => b = I.
Vậy Cu có hóa trị I
– AlCl3: Gọi c là hóa trị của Al
Theo quy tắc hóa trị ta có: 1.c = 3.I => c = III.
Vậy Al có hóa trị III
b) Tính hóa trị của Fe trong hợp chất FeSO4.
Trong công thức hóa học FeSO4: Gọi hóa trị của Fe là x, nhóm (SO4) có hóa trị II. Theo quy tắc hóa trị ta có:
1.x = 1.II => x = II
Vậy Fe có hóa trị II trong hợp chất FeSO4
Bài 5 trang 38
a) Lập công thức hóa học của những hợp chất tạo bởi hai nguyên tố sau : P(III) và H ; C(IV) và S(II) ; Fe(III) và O.
Bài giải:
– P(III) và H
Công thức chung là:
Theo quy tắc hóa trị ta có: x.III = y.I
⇒ x = 1 , y = 3
⇒ PxHy có công thức PH3
– C(IV) và S(II):
Công thức chung là:
Theo quy tắc hóa trị ta có: x.IV = y.II
⇒ x = 1 , y = 2
⇒ CxSy có công thức CS2
– Fe(III) và O
Công thức chung là:
Theo quy tắc hóa trị ta có: x.III = y.II
⇒ x = 2 , y = 3
⇒ FexOy có công thức Fe2O3
b) Lập công thức hóa học của những hợp chất tạo bởi một nguyên tố và nhóm nguyên tử sau: Na(I) và OH(I) ; Cu(II) và (SO4)(II) ; Ca(II) và (NO3)(I).
Bài giải:
– Na(I) và OH(I)
Công thức chung là:
Theo quy tắc hóa trị ta có: x.I = y.I
⇒ x =1 , y =1
⇒ Nax(OH)y có công thức NaOH
– Cu(II) và (SO4)(II)
Công thức chung là:
Theo quy tắc hóa trị ta có: x.II = y.II
⇒ x =1 , y =1
⇒ Cux(SO4)y có công thức CuSO4
– Ca(II) và (NO3)(I)
Công thức chung là:
Theo quy tắc hóa trị ta có: x.II = y.I
⇒ x =1 , y =2
⇒ Cax(NO3)y có công thức Ca(NO3)2
Bài 6 trang 38
Một số công thức hoá học viết như sau:
MgCl, KO, CaCl2, NaCO3.
Cho biết: Mg, Ca nhóm (CO3) có hóa trị II ; Cl, K, Na có hóa trị I. Hãy chỉ ra những công thức hóa học viết sai và sửa lại cho đúng.
Bài giải:
– MgCl:
Theo quy tắc hóa trị ta có: II.1 ≠ 1.I ⇒ Công thức MgCl sai.
Gọi công thức chung là MgxCly
Theo quy tắc hóa trị ta có II.x = I.y
⇒ x = 1 , y = 2
⇒ Công thức đúng là MgCl2
– KO:
Theo quy tắc hóa trị ta có: I.1 ≠ II.1 ⇒ Công thức KO sai.
Gọi công thức chung là KxOy
Theo quy tắc hóa trị ta có I.x= II.y
⇒ x = 2 , y = 1
⇒ Công thức đúng là K2O
– CaCl2:
Theo quy tắc hóa trị ta có: II.1 = I.2 ⇒ Công thức CaCl2 đúng.
– NaCO3:
Theo quy tắc hóa trị ta có: I.1 ≠ II.1 ⇒ Công thức NaCO3 sai.
Gọi công thức chung là Nax(CO3)y
Theo quy tắc hóa trị ta có I.x = II.y
⇒ x = 2 , y = 1
⇒ Công thức đúng là Na2CO3
Bài 7 trang 38
Hãy chọn công thức hóa học phù hợp với hóa trị IV của nitơ trong số các công thức cho sau đây : NO, N2O3, N2O, NO2.
Bài giải:
Gọi công thức hóa học là: NxOy
Theo quy tắc hóa trị ta có x.1 = y.II
⇒ x = 1 , y = 2
⇒ NxOy có công thức NO2
Bài 8 trang 38
a) Tìm hóa trị của Ba và nhóm (PO4) trong bảng 1 và bảng 2 (trang 42, 43).
Hóa trị của Ba là II và nhóm (PO4) bằng III.
b) Hãy chọn công thức hóa học đúng trong số các công thức cho sau đây :
A. BaPO4 B. Ba2PO4 C. Ba3PO4 D. Ba3(PO4)2
Bài giải:
Gọi công thức hóa học là: Bax(PO4)y
Theo quy tắc hóa trị ta có: II.x = III.y
⇒ x = 3 , y = 2
⇒ Bax(PO4)y có công thức Ba3(PO4)2
⇒ Chọn đáp án D.
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 8 bài 10 – Hóa trị:
Bài 10.1 trang 14
Chép vào vở bài tập những câu sau đây với đầy đủ các từ hay cụm từ thích hợp chọn trong khung
| Hóa trị, nguyên tử, nguyên tố, nhóm nguyên tử, khả năng liên kết, phân tử. |
“Hoá trị là con số biểu thị ………. của …… nguyên tố này (hay …………) với ………. nguyên tố khác. Hoá trị của một …….. (hay ……..…) được xác định theo ………… của H chọn làm đơn vị và ……… của O là hai đơn vị”.
Bài giải:
Hoá trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này (hay nhóm nguyên tử) với nguyên tử nguyên tố khác. Hoá trị của một nguyên tố (hay nhóm nguyên tử) được xác định theo hoá trị của H chọn làm đơn vị và hoá trị của O là hai đơn vị.
Bài 10.2 trang 14
Người ta quy ước mỗi vạch ngang giữa hai kí hiệu biểu thị một hoá trị của mỗi bên nguyên tử. Cho biết sơ đồ công thức của hợp chất giữa nguyên tố X, Y với H và O như sau :
H – X – H ; X = O ; H – Y
a) Xác định hoá trị của X và Y.
b) Viết sơ đồ công thức của hợp chất giữa hai nguyên tố Y và O, giữa hai nguyên tố X và Y.
Bài giải:
a) Hóa trị của X và Y là:
X = O ⇒ X là hóa trị II
H – Y ⇒ Y là hóa trị I
b) Sơ đồ công thức của hợp chất giữa Y và O, X và Y
Y – O – Y
Y – X – Y.
Bài 10.3 trang 14
Viết sơ đồ công thức của các hợp chất sau : HCl ; H2O ; NH3; CH4.
Bài giải:
– HCl:
H – Cl
– H2O:
H – O – H
– NH3
– CH4
Bài 10.4 trang 14
Tính hoá trị của mỗi nguyên tố trong công thức hoá học của các hợp chất sau, cho biết S hoá trị II :
K2S ; MgS ; Cr2S3 ; CS2.
Bài giải:
– K2S
Gọi a là hóa trị của K:
Theo quy tắc hóa trị ta có: a.2 = II.1
⇒ a = I
⇒ Vậy K có hóa trị I.
– MgS
Gọi b là hóa trị của Mg:
Theo quy tắc hóa trị ta có: b.1 = II.1
⇒ b = II
⇒ Vậy Mg có hóa trị II.
– Cr2S3
Gọi c là hóa trị của Cr:
Theo quy tắc hóa trị ta có: c.2 = II.3
⇒ c = III
⇒ Vậy Cr có hóa trị III.
– CS2
Gọi d là hóa trị của C:
Theo quy tắc hóa trị ta có: d.1 = II.2
⇒ d = IV
⇒ Vậy C có hóa trị IV.
Bài 10.5 trang 14
Tính hoá trị của mỗi nguyên tố trong công thức hoá học của các hợp chất sau, biết nhóm (NO3) hoá trị I và nhóm (CO3) hoá trị II :
Ba(NO3)2; Fe(NO3)3; CuCO3 ; Li2CO3.
Bài giải:
– Ba(NO3)2
Gọi a là hóa trị của Ba:
Theo quy tắc hóa trị ta có: a.1 = I.2
⇒ a = II
⇒ Vậy Ba có hóa trị II.
– Fe(NO3)3
Gọi b là hóa trị của Fe:
Theo quy tắc hóa trị ta có: b.1 = I.3
⇒ b = III
⇒ Vậy Fe có hóa trị III.
– CuCO3
Gọi c là hóa trị của Cu:
Theo quy tắc hóa trị ta có: c.1 = II.1
⇒ c = II
⇒ Vậy Cu có hóa trị II.
– Li2CO3
Gọi d là hóa trị của Li:
Theo quy tắc hóa trị ta có: d.2 = II.1
⇒ d = I
⇒ Vậy Li có hóa trị I.
Bài 10.6 trang 14
Lập công thức hoá học của những hợp chất hai nguvên tố như sau :
P(III) và H P(V) và O
Fe(III) và Br(I) Ca và N(III)
Bài giải:
– P(III) và H
Gọi công thức hóa học là: PxHy
Theo quy tắc hóa trị ta có: x.III = y.I
⇒ x = 1 , y = 3
⇒ PxHy có công thức PH3
– P(V) và O
Gọi công thức hóa học là: PxOy
Theo quy tắc hóa trị ta có: V.x = II.y
⇒ x = 2 , y = 5
⇒ PxOy có công thức P2O5
– Fe(III) và Br(I)
Gọi công thức hóa học là: FexBry
Theo quy tắc hóa trị ta có: III.x = I.y
⇒ x = 1 , y = 3
⇒ FexBry có công thức FeBr3
– Ca và N(III)
Gọi công thức hóa học là: CaxNy
Theo quy tắc hóa trị ta có: II.x = III.y
⇒ x = 3 , y = 2
⇒ CaxNy có công thức Ca3N2
Bài 10.7 trang 14
Lập công thức hoá học của những hợp chất tạo bởi một nguyên tố và nhóm nguyên tử như sau :
Ba và nhóm (OH); Al và nhóm (NO3).
Cu(II) và nhóm (CO3); Na và nhóm (PO4)(III).
Bài giải:
– Ba và nhóm (OH)
Gọi công thức hóa học là: Bax(OH)y
Theo quy tắc hóa trị ta có: II.x = I.y
⇒ x = 1 , y = 2
⇒ Bax(OH)y có công thức Ba(OH)2
– Al và nhóm (NO3)
Gọi công thức hóa học là: Alx(NO3)y
Theo quy tắc hóa trị ta có: III.x = I.y
⇒ x = 1 , y = 3
⇒ Alx(NO3)y có công thức Al(NO3)3
– Cu(II) và nhóm (CO3)
Gọi công thức hóa học là: Cux(CO3)y
Theo quy tắc hóa trị ta có: II.x = II.y
⇒ x = 1 , y = 1
⇒ Cux(CO3)y có công thức CuCO3
– Na và nhóm (PO4)(III)
Gọi công thức hóa học là: Nax(PO4)y
Theo quy tắc hóa trị ta có: I.x = III.y
⇒ x = 3 , y = 1
⇒ Nax(PO4)y có công thức Na3PO4
Bài 10.8 trang 15
a) Biết Cr (crom) có hai hoá trị thường gặp là II và III, hãy chọn những công thức hoá học đúng trong số các công thức cho sau đây :
(1) CrSO4 ; (2) Cr2SO4 ; (3) CrO ; (4) CrO2
(5) Cr(SO4)2 ; (6) Cr2(SO4)3 ; (7) Cr2O ; (8) Cr2O3
b) Tính phân tử khối của những chất biểu diễn bởi công thức hoá học đúng.
Bài giải:
a) Những công thức hoá học đúng là:
Cr hoá trị II : CrSO4, CrO.
Cr hoá trị III : Cr2(SO4)3, Cr2O3.
b) Phân tử khối:
CrSO4 = 52 + 32 + 4 x 16 = 148 đvC
CrO = 52 + 16 = 68 đvC
Cr2(SO4)3 = 2 x 52 + 3(32 + 4 x 16) = 392 đvC
Cr2O3 = 2 x 52 + 3 x 16 = 152 đvC
Bài 10.9 trang 15
Người ta xác định được rằng, nguyên tố silic (Si) chiếm 87,5% về khối lượng trong hợp chất với nguyên tố hiđro.
a. Viết công thức hoá học và tính phân tử khối của hợp chất.
b. Xác định hoá trị của silic trong hợp chất.
Bài giải:
a. Công thức hoá học và tính phân tử khối của hợp chất là:
Gọi công thức chung của hợp chất là SixHy
Theo đề ta có:
Vậy công thức hóa học của hợp chất là SiH4
Phân tử khối của SiH4 là: 28 + 4.1 = 32 đvC
b. Hóa trị của Silic trong hợp chất SiH4 là IV
Bài 10.10 trang 15
Phân tích một mẫu hợp chất tạo bởi hai nguyên tố là sắt và oxi. Kết quả cho thấy cứ 7 phần khối lượng sắt có tương ứng với 3 phần khối lượng oxi.
a. Viết công thức hoá học và tính phân tử khối của hợp chất.
b. Xác định hoá trị của sắt trong hợp chất.
Bài giải:
a. Công thức hoá học và tính phân tử khối của hợp chất là:
Gọi công thức chung của hợp chất là FexOy
Theo đề ta có:
Vậy công thức hóa học của hợp chất là Fe2O3
Phân tử khối của Fe2O3 là: 56.2 + 16.3 = 160 đvC
b. Hoá trị của sắt trong hợp chất là:
Gọi x là hóa trị của Fe trong hợp chất Fe2O3:
Theo quy tắc hóa trị ta có: x. 2 = 3.II
⇒ x = III
⇒ Vậy Fe có hóa trị III.
Đây là nội dung tóm tắt và giải bài tập Chương 1 bài 10: Hóa trị của chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8