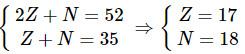Tóm tắt và giải hóa lớp 10 bài 6 – Luyện tập: Cấu tạo vỏ nguyên tử
Tóm tắt và giải hóa lớp 10 bài 6 – Luyện tập: Cấu tạo vỏ nguyên tử
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 10 bài 6 mà bạn có thể tham khảo để học hóa tốt hơn !

1. Tóm tắt hóa học lớp 10 bài 6:
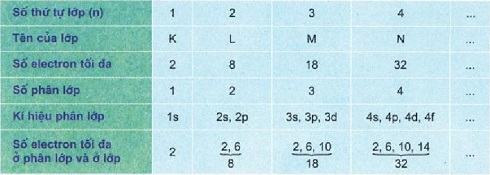
Lớp và phân lớp electron :
Mối liên hệ giữa lớp electron ngoài cùng với loại nguyên tố :
2. Hướng dẫn giải bài tập Hóa học 10 bài 6:
Bài 1 trang 30
Thế nào là nguyên tố s, p, d, f ?
Bài giải :
– Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
– Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
– Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
– Nguyên tố f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
Bài 2 trang 30
Các electron thuộc lớp K hay lớp L liên kết với hạt nhân chặt chẽ hơn ? Vì sao ?
Bài giải :
Các electron thuộc lớp K liên kết với hạt nhân chặt chẽ hơn lớp L vì gần hạt nhân hơn và mức năng lượng thấp hơn.
Bài 3 trang 30
Trong nguyên tử, những electron của lớp nào quyết định tính chất hoá học của nguyên tử nguyên tố đó ? Cho thí dụ.
Bài giải :
Trong nguyên tử, những electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tử nguyên tố.
Thí dụ :
Liti, natri có 1e ở lớp ngoài cùng nên thể hiện tính chất của kim loại.
Oxi và lưu huỳnh đều có 6e ở lớp ngoài cùng nên thể hiện tính chất của phi kim.
Bài 4 trang 30
Vỏ electron của một nguyên tử có 20 electron. Hỏi :
a) Nguyên tử đó có bao nhiêu lớp electron ?
b) Lớp ngoài cùng có bao nhiêu electron ?
c) Nguyên tố đó là nguyên tố kim loại hay phi kim ?
Bài giải :
Nguyên tử có 20 electron nghĩa là có 20 proton hay số đơn vị điện tích hạt nhân là 20.
Cấu hình electron là : 1s22s22p63s23p64s2
a) Nguyên tử có 4 lớp electron.
b) Lớp ngoài cùng có 2 electron.
c) Do nguyên tử nguyên tử có 2e lớp ngoài cùng nên nguyên tố đó là kim loại.
Bài 5 trang 30
Cho biết số electron tối đa ở các phân lớp sau :
a) 2s b) 3p c) 4s d) 3d
Bài giải :
Số electron tối đa ở các phân lớp s, p, d, f tương ứng là 2, 6, 10, 14. Do đó, ta có:
a) 2s có tối đa 2e.
b) 3p có tối đa 6e.
c) 4s có tối đa 2e.
d) 3d có tối đa 10e.
Bài 6 trang 30
Cấu hình electron của nguyên tử photpho là 1s22s22p63s23p3. Hỏi :
a) Nguyên tử photpho có bao nhiêu electron ?
b) Số hiệu nguyên tử của photpho là bao nhiêu ?
c) Lớp electron nào có mức năng tượng cao nhất ?
d) Có bao nhiêu lớp electron, mỗi lớp có bao nhiêu electron ?
e) Photpho là nguyên tố kim loại hay phi kim ? Vì sao ?
Bài giải :
a) Nguyên tử photpho có 15e.
b) Số hiệu nguyên tử của photpho là 15.
c) Lớp thứ 3 có mức năng lượng cao nhất.
d) Có 3 lớp e : Lớp thứ nhất có 2 e, lớp thứ 2 có 8 e, lớp thứ 3 có 5 e.
e) Photpho là phi kim vì có 5e ở lớp ngoài cùng.
Bài 7 trang 30
Cấu hình electron của nguyên tử cho ta những thông tin gì ? Cho thí dụ.
Bài giải :
Cấu hình electron của nguyên tử cho ta biết : sự phân bố electron trên các lớp và phân lớp. Qua cấu hình electron ta biết được cấu tạo nguyên tử, vị trí của nguyên tố trong bảng tuần hoàn và tính chất hóa học đặc trưng của nguyên tố đó.
Thí dụ:
Nguyên tố Na có cấu hình electron là : 1s22s22p63s1
– Cấu tạo nguyên tử : điện tích hạt nhân là 11+, nguyên tử có 3 lớp electron và có 1e ở lớp ngoài cùng.
– Vị trí của nguyên tố trong bảng tuần hoàn : ô số 11, chu kì 3, nhóm IA.
– Tính chất hóa học đặc trưng : do có 1e lớp ngoài cùng nên Na là một kim loại mạnh.
Bài 8 trang 30
Viết cấu hình electron đầy đủ cho các nguyên tử có lớp electron ngoài cùng là :
a) 2s1 b) 2s22p3 c) 2s22p6
d) 3s23p3 e) 3s23p5 g) 2s22p6
Bài giải :
a) 1s22s1.
b) 1s22s22p3
c) 1s22s22p6
d) 1s22s22p63s23p3
e) 1s22s22p63s23p5
g) 1s22s22p63s23p6
Bài 9 trang 30
Cho biết tên, kí hiệu, số hiệu nguyên tử của :
a) 2 nguyên tố mà nguyên tử có số electron lớp ngoài cùng là tối đa.
b) 2 nguyên tố mà nguyên tử có 1 electron ở lớp ngoài cùng.
c) 2 nguyên tố mà nguyên tử có 7 electron ở lớp ngoài cùng.
Bài giải :
a) 2 nguyên tố mà nguyên tử có số electron lớp ngoài cùng là tối đa :
2010Ne : 1s22s22p6
4010Ar : 1s22s22p63s23p6
b) 2 nguyên tố mà nguyên tử có 1 electron ở lớp ngoài cùng :
2311Na : 1s22s22p63s1
3919K : 1s22s22p63s23p64s1
c) 2 nguyên tố mà nguyên tử có 7 electron ở lớp ngoài cùng :
199F : 1s22s22p5
3517Cl : 1s22s22p63s23p5
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 10 bài 6:
Bài 6.1 trang 14
Nguyên tử photpho 3115P có khối lượng m = 30,98u.
Số khối của photpho là
A. 30,98 B. 31
C. 30,98 g/mol D. 15
Nguyên tử khối của P là
A. 30,98 B. 31
C. 30,98 g/mol D. 15
Khối lượng mol nguyên tử của P là
A. 30,98 B. 31
C. 30,98 g/mol D. 15
Bài giải :
a) Số khối của photpho là 31 ⇒ Chọn đáp án B.
b) Nguyên tử khối của photpho là 30,98 ⇒ Chọn đáp án A.
c) Khối lượng mol nguyên tử của photpho là 30,98 g/mol ⇒ Chọn đáp án C.
Bài 6.2 trang 14
Một nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 52 và có số khối là 35. Số electron ở lớp vỏ nguyên tử nguyên tố X là
A. 18. B. 23. C. 15. D. 17.
Bài giải :
Ta có hệ phương trình :
Z = số p = số e = 17
⇒ Chọn đáp án D.
Bài 6.3 trang 15
Cấu hình electron nguyên tử photpho là 1s22s22p63s23p3 hoặc [Ne]3s23p3
Phân lớp electron có mức năng lượng cao nhất, số e lớp ngoài cùng của photpho lần lượt là
A. 1s, 2 B. 2p, 6
C. 3s, 2 D. 3p, 5
Bài giải :
Electron cuối cùng của photpho được điền vào phân lớp p.
Lớp ngoài cùng là lớp 3 có 5e.
⇒ Chọn đáp án D.
Bài 6.4 trang 15
Một nguyên tử có số hiệu nguyên tử là 16.
a) Nguyên tử đó có bao nhiêu electron ?
b) Hãy viết công thức biểu diễn cấu hình electron của nguyên tử đó.
c) Lớp electron ngoài cùng của nguyên tử đó có bao nhiêu electron, đó là những electron gì ?
d) Đó là nguyên tử của một nguyên tố kim loại hay phi kim ?
Bài giải :
a) Nguyên tử có 16 electron.
b) 1s22s22p63s23p4
c) Lớp electron ngoài cùng có 6 electron trong đó có 2 electron s và 4 electron p.
d) Đó là nguyên tử của một nguyên tố phi kim.
Bài 6.5 trang 15
Thế nào là nguyên tố s, nguyên tố p, nguyên tố d, nguyên tố f ?
Bài giải :
– Nguyên tố s là nguyên tố mà trong nguyên tử, electron cuối cùng được điền vào phân lớp s.
– Nguyên tố p là nguyên tố mà trong nguyên tử, electron cuối cùng được điền vào phân lớp p.
– Nguyên tố d là nguyên tố mà trong nguyên tử, electron cuối cùng được điền vào phân lớp d.
– Nguyên tố f là nguyên tố mà trong nguyên tử, electron cuối cùng được điền vào phân lớp f.
Bài 6.6 trang 15
Một số nguyên tử có cấu hình electron như sau :
X. 1s22s22p1
Y. 1s22s2
Z. 1s22s22p63s23p6
Hỏi nguyên tử nào là nguyên tử của một nguyên tố s ?
Bài giải :
Nguyên tử có cấu hình X: 1s22s22p1 và Z: 1s22s22p63s23p6 là nguyên tố p vì e cuối cùng điền vào phần lớp p.
Nguyên tử có cấu hình Y: 1s22s2 là nguyên tố s vì e cuối cùng điền vào phân lớp s.
Vậy nguyên tử có cấu hình Y là nguyên tử của một nguyên tố s.
Bài 6.7 trang 15
Một số nguyên tử có cấu hình electron như sau :
X. 1s22s22p1
Y. 1s22s2
Z. 1s22s22p63s23p63d64s2
Hỏi nguyên tử nào là nguyên tử của một nguyên tố p ?
Hỏi nguyên tử nào là nguyên tử của một nguyên tố d ?
Bài giải :
– Nguyên tử có cấu hình X: 1s22s22p1 là nguyên tố p vì e cuối cùng điền vào phân lớp p.
– Nguyên tử có cấu hình Z: 1s22s22p63s23p63d64s2 là nguyên tố d vì e cuối cùng điền vào phân lớp d.
Ở đây mức năng lượng cao nhất là mức 3d. Vì vậy electron cuối cùng được điền vào phân lớp 3d (mức 4s thấp hơn mức 3d).
Bài 6.8 trang 15
Trong một nguyên tử, tổng số các hạt : proton, nơtron và electron bằng 28. Biết rằng số nơtron bằng số proton cộng thêm một.
a) Hãy cho biết số proton có trong nguyên tử.
b) Hãy cho biết số khối của hạt nhân.
c) Viết cấu hình electron của nguyên tử.
d) Hãy cho biết đó là nguyên tử của nguyên tố nào ?
Bài giải :
Gọi X là số proton. Vì số proton bằng số electron nên X cũng là số electron. Theo đề bài, số nơtron bằng (x + 1). Từ đó ta có phương trình :
2x + x + 1 = 28
⇔ 3x = 28 – 1
⇔ 3x = 27
⇒ x = 9
a) Số proton là 9, số nơtron là 10, số electron là 9e.
b) Số khối A = 9 + 10= 19.
c) Với 9 electron, cấu hình electron sẽ là 1s22s22p5
d) Với Z = 9. Đó là nguyên tố flo (F).
Bài 6.9 trang 15
Hãy cho biết số electron ở lớp ngoài cùng của các nguyên tử có số electron lần lượt bằng :
a) 3 b) 5 c) 6 d) 8
Bài giải :
a) Cấu hình electron : 1s22s1 ⇒ 1 electron ở lớp ngoài cùng.
b) Cấu hình electron : 1s22s22p1 ⇒ 3 electron ở lớp ngoài cùng.
c) Cấu hình electron : 1s2s22p2 ⇒ 4 electron ở lớp ngoài cùng.
d) Cấu hình electron : 1s22s22p4 ⇒ 6 electron ở lớp ngoài cùng.
Bài 6.10 trang 16
Điện tích của electron qe = -1,602.10-19C (culong). Hãy tính điện tích của hạt nhân nguyên tử cacbon ra đơn vị culông.
Bài giải :
Điện tích của electron : qe = -1,602.10-19C
Proton mang điện tích dương : qp = +1,602.10-19C
Hạt nhân cacbon có 6 proton, vây điện tích của hạt nhân nguyên tử cacbon bằng :
q = 1,602.10-19 x 6 = 9,612.10-19C
Bài 6.11 trang 16
Urani có hai đồng vị chính là 23592U và 23892U. Hãy cho biết số nơtron trong mỗi loại đồng vị đó.
Bài giải :
Số nơtron trong mỗi loại đồng vị là :
Đồng vị 23592U có : 235 – 92 = 143 (nơtron)
Đồng vị 23892U có : 238 – 92 = 146 (nơtron)
Bài 6.12 trang 16
Cho biết số Avogađro N = 6,022.1023
a) Hãy cho biết 1 mol nhôm, 10 mol nhôm có bao nhiêu nguyên tử nhôm (Al) ?
b) Biết rằng 10 mol nhôm có khối lượng bằng 269,7 gam. Hãy tính khối lượng mol nguyên tử của nhôm.
Bài giải :
a) 1 mol nhôm có 6,022.1023 nguyên tử nhôm.
10 mol nhôm có : 6,022.1023 x 10 = 6,022.1024 (nguyên tử nhôm)
b) Khối lượng mol nguyên tử nhôm :
MAl = 269,7 : 10 = 26,97 g/mol
Bài 6.13 trang 16
Liti tự nhiên có hai đồng vị : 73Li và 63Li
Biết rằng nguyên tử khối trung bình của liti tự nhiên là 6,94.
Hỏi thành phần phần trăm (%) của mỗi đồng vị đó trong liti tự nhiên ?
(Coi nguyên tử khối trùng với số khối).
Bài giải :
Gọi x là thành phần phần trăm của đồng vị 7Li ⇒ Thành phần phần trăm của đồng vị 6Li sẽ là : 100 – x. Từ đó ta có phương trình :
Giải ra ta được x = 94 (94% 7Li ) và 100 – x = 6 (6% 6Li ).
Vậy có 94% 7Li và 6% 6Li trong liti tự nhiên.
Bài 6.14 trang 16
Brom có 2 đồng vị : 7935Br hàm lượng 50,7%; 8135Br hàm lượng 49,3% (so với tổng khối lượng của brom tự nhiên).
Hãy tính nguyên tử khối trung bình Ā của brom.
(Coi nguyên tử khối trùng với số khối).
Bài giải :
Nguyên tử khối trung bình A của brom :
Bài 6.15 trang 16
Tổng số các hạt proton, nơtron, electron trong nguyên tử của một nguyên tố X (thuộc nhóm VIIA) là 28. Hãy viết cấu hình electron của nguyên tử nguyên tố đó.
Bài giải :
Nguyên tố cần tìm thuộc nhóm VIIA nên nguyên tử có 7e ở lớp ngoài cùng. Vì lớp thứ nhất chỉ chứa tối đa 2e nên nguyên tử của nguyên tố này phải có ít nhất 2 lớp electron (n ≥ 2).
– Nếu n = 2, có 2 lớp e, số e ở các lớp là : 2,7
⇒ Nguyên tử gồm : 9p, 9e và 10n (tổng số hạt là 28, phù hợp đề bài).
– Nếu n = 3, có 3 lớp e, số e ở các lớp là : 2, 8, 7
Chỉ riêng số p + số e = 17 + 17 = 34 > 28
⇒ Không phù hợp với đề bài.
Vậy nguyên tố cần tìm có Z = 9 và cấu hình electron : 1s22s22p5
Bài 6.16 trang 16
Cho những nguyên tố có số hiệu nguyên tử từ Z = 1 đến Z = 36. Tìm những nguyên tố có cấu hình electron thỏa mãn 2 điều kiện :
+ Lớp ngoài cùng có 8e.
+ Lớp ngoài cùng chứa số e tối đa.
Bài giải :
Trong những nguyên tố có số hiệu nguyên tử từ Z = 1 đến Z = 36, chỉ có nguyên tố neon là có cấu hình electron thoả mãn 2 điều kiện của đề bài.
Ne : 1s22s22p6
Các nguyên tố khác :
He : bên ngoài chỉ có 2e.
Ar : 2/8/8 lớp ngoài cùng có 8e, nhưng lớp thứ 3 chưa đủ số e tối đa.
Kr : 2/8/18/8 lớp ngoài cùng có 8e, nhưng lớp thứ 4 chưa đủ số e tối đa.
Đây là nội dung tóm tắt và giải bài tập Chương 1 bài 6 – Luyện tập: Cấu tạo vỏ nguyên tử của chương trình hóa học lớp 10 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 10