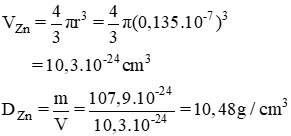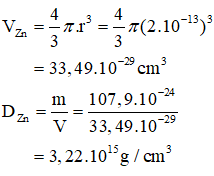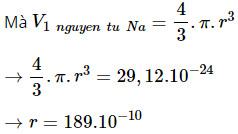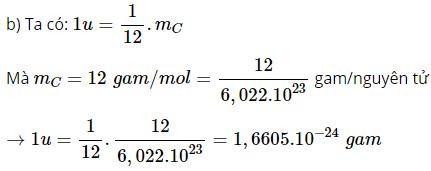Tóm tắt và giải hóa lớp 10 bài 1: Thành phần nguyên tử
Tóm tắt và giải hóa lớp 10 bài 1: Thành phần nguyên tử
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 10 bài 1 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 10 bài 1:
a) Cấu tạo nguyên tử:
– Nguyên tử là những hạt vô cùng nhỏ bé và trung hòa về điện.
– Nguyên tử được chia làm 2 phần chính: đó là vỏ và hạt nhân.
– Mọi nguyên tử đều cấu tạo từ ba loại hạt : proton, nơtron và electron.
– Hầu hết khối lượng nguyên tử đều tập trung ở hạt nhân mặc dù hạt nhân chỉ chiếm một phần rất nhỏ thể tích của nguyên tử.
– Hạt nhân nguyên tử được tạo thành bởi các proton và nơtron. Vì nơtron không mang điện, số proton trong hạt nhân phải bằng số đơn vị điện tích dương của hạt nhân và bằng số electron quay xung quanh hạt nhân.
b) Khối lượng, kích thước của nguyên tử:
Kích thước nguyên tử:
- Để biểu thị kích thước nguyên tử, ta dùng đơn vị nanomet (nm) hay angstrom (Å)
1nm = 10-9 m, 1 Å = 10-10 m, 1nm = 10 Å
- Nguyên tử nhỏ nhất là nguyên tử hiđro có bán kính khoảng 0,053nm.
- Đường kính của hạt nhân còn nhỏ hơn, nó rơi vào khoảng 10-5 nm. Như vậy đường kính nguyên tử lớn hơn đường kính hạt nhân khoảng 10000 lần.
- Đường kính electron và proton còn nhỏ hơn nhiều (khoảng 10-8 nm), electron chuyển động xung quanh hạt nhân trong không gian rỗng của nguyên tử.
Khối lượng nguyên tử:
- Để biểu thị khối lượng của nguyên tử, phân tử và các loại hạt, ta dùng đơn vị khối lượng nguyên tử ký hiệu là u (đvC)
1 u bằng 1/12 khối lượng của một nguyên tử đồng vị cacbon -12.
Bảng điện tích và khối lượng của các hạt tạo nên nguyên tử.
| Loại hạt | Kí hiệu | Điện tích | Khối lượng |
| Proton | p | qp = +1,602.10-19 (C) hay qp = 1+ | mp = 1,6726.10-27 (kg) ≈ 1u |
| Nơtron | n | qp = 0 | mn = 1,6748.10-27 (kg) ≈ 1u |
| Electron | e | qp = -1,602.10-19 (C) hay qp = 1- | me = 9,1094.10-31 (kg) |
2. Hướng dẫn giải bài tập Hóa học 10 bài 1:
Bài 1 trang 9
Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và proton.
B. proton và nơtron.
C. nơtron và electron.
D. electron, proton và nơtron.
Chọn đáp án đúng.
Bài giải :
Chọn đáp án B.proton và nơtron.
Bài 2 trang 9
Các hạt cấu tạo nên hầu hết các nguyên tử là
A. proton và electron.
B. nơtron và electron.
C. nơtron và proton.
D. nơtron, proton và electron.
Chọn đáp án đúng.
Bài giải :
Chọn đáp án D. nơtron, proton và electron.
Bài 3 trang 9
Nguyên tử có đường kính lớn gấp khoảng 10 000 lần đường kính hạt nhân. Nếu ta phóng đại hạt nhân lên thành một quả bóng có đường kính 6 cm thì đường kính nguyên tử sẽ là
A. 200 m.
B. 300 m.
C. 600 m.
D. 1200 m.
Chọn đáp số đúng.
Bài giải :
Đường kính hạt nhân khi phóng to : 6 cm.
Đường kính nguyên tử sau khi phóng đại là: 6 x 10 000 = 60 000 cm = 600 m.
Chọn đáp án C.
Bài 4 trang 9
Tìm tỉ số về khối lượng của electron so với proton, so với nơtron.
Bài giải :
Ta có:
me = 9,1094.10-31
mp = 1,6726.10-27
mn = 1,6748.10-27
Tỉ số về khối lượng của electron so với proton là:
me / mp = 9,1094.10-31 / 1,6726.10-27 ≈ 1/1836
Tỉ số về khối lượng của electron với nơtron là:
me / mn = 9,1094.10-31 / 1,6748.10-27 ≈ 1/1839
Bài 5 trang 9
Nguyên tử kẽm có bán kínhr = 1,35.10-1 nm và có khối lượng nguyên tử là 65 u.
a) Tính khối lượng riêng của nguyên tử kẽm.
b) Thực tế hầu như toàn bộ khối lượng nguyên tử tập trung ở hạt nhân với bán kính r = 2.10-6 nm. Tính khối lượng riêng của hạt nhân nguyên tử kẽm.
Cho biết Vhình cầu = 4/3 π.r3
Bài giải :
a) Khối lượng riêng của nguyên tử kẽm:
rZn = 1,35. 10-1 nm = 0,135.10-7 cm (1 nm = 10-9 m)
1u = 1,6600.10-24 g.
mZn = 65.1,6600.10-24 g = 107,9.10-24 g.
b) Khối lượng riêng của hạt nhân nguyên tử kẽm:
mhạt nhân Zn = 65u ⇒ 107,9.10-24 gam.
rhạt nhân Zn = 2.10-6 nm = (2.10-6.10-7) cm = 2.10-13 cm.
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 10 bài 1:
Bài 1.1 trang 3
Beri và oxi lần lượt có khối lượng nguyên tử bằng:
mBe = 9,012u; mO = 15,999u.
Khối lượng nguyên tử beri và oxi tính theo gam lần lượt là
A. 14,964.10-24 gam và 26.566.10-24 gam
B. 26,566.10-24 gam và 14,964.10-4 gam
C. 15.10-24 gam và 26.10-24 gam
D. 9 gam và 16 gam
Bài giải :
Ta có: 1u = 1,6605.10-24 gam
mBe = 9,012u = 9,012.1,6605.10-24 gam = 14,964.10-24 gam
mO = 15,999u = 15,999.1,6605.10-24 gam = 26,566.10-24 gam
⇒ Chọn đáp án A.
Bài 1.2 trang 3
Trong nguyên tử, hạt mang điện dương là
A. electron B. proton C. nơtron D. proton và nơtron
Bài giải :
Hạt mang điện tích dương trong nguyên tử là proton.
⇒ Chọn đáp án B.
Bài 1.3 trang 3
Phát biểu nào sau đây đúng ?
A. Hạt nhân nguyên tử hiđro có 1 proton
B. Hạt nhân nguyên tử hiđro chỉ có 1 proton, không có nơtron
C. Hạt nhân nguyên tử của các đồng vị của hiđro đều có proton và nơtron
D. Hạt nhân nguyên tử của các đồng vị của hiđro đều có nơtron
Bài giải :
Chọn đáp án B.
Bài 1.4 trang 4
Khối lượng riêng của natri kim loại bằng 0,97g/cm3. Trong tinh thể kim loại natri, các nguyên tử chiếm 74% thể tích, còn lại là các khe rỗng. Bán kính nguyên tử Natri gần bằng
A. 189 pm. B. 266 pm. C. 170 pm. D. 250 pm.
Bài giải :
Vtinh thể = mNa / DNa = 22,99/0,97 = 23,7 cm3
Mà trong tinh thể kim loại, không gian trống chiếm 26% thể tích :
V1 mol Na = 0,74 x Vtinh thể = 0,74 x 23,7 = 17,54 cm3
Ta có : 1 mol Na = 6,022.1023 nguyên tử Na.
→ V1 nguyên tử Na = V1 mol Na / 6,022.1023
= 17,54 / 6,022.1023
= 29,12.10-24
⇒ Chọn đáp án A.
Bài 1.5 trang 4
Theo định nghĩa, số Avogađro là một số bằng số nguyên tử đồng vị cacbon-12 có trong 12 g đồng vị cacbon-12.
Số Avogađro được kí hiệu là N.
N = 6,0221415.1023 thường lấy là 6,022.10S23
a. Hãy tính khối lượng của một nguyên tử đồng vị cacbon-12.
b. Hãy tính số nguyên tử có trong 1 gam đồng vị cacbon-12.
Bài giải :
a. Trong 12 gam đồng vị cacbon-12 có 6,022.1023 nguyên tử.
→ m1 nguyên tử C = 12 : (6.022.1023) = 1.9927.10-23 gam
b. Số nguyên tử có trong 1 gam đồng vị cacbon-12 :
n = (6.022.1023) : 12 = 5,018.1022 nguyên tử
Bài 1.6 trang 4
a) Hãy định nghĩa thế nào là một đơn vị khối lượng nguyên tử (u).
b) Hãy tính đơn vị khối lượng nguyên tử (u) ra gam.
c) Hãy cho biết khối lượng nguyên tử đồng vị cacbon-12 tính ra đơn vị khối lượng nguyên tử u.
d) Biết rằng khối lượng của nguyên tử đồng vị cacbon-12 gấp 11,9059 lần khối lượng của nguyên tử hiđro (H), hãy tính khối lượng của nguyên tử hiđro ra u.
Bài giải :
a) Một đơn vị khối lượng nguyên tử bằng 1/12 khối lượng của một nguyên tử đồng vị cacbon-12 (mC).
c) Vì 1u = 1/12.mC → mC = 12u.
d) Vì 1u = 1/12.mC → mC = 12u
Mà mC = 11,9059.mH
→ 12u = 11,9059.mH
→ mH = 12u / 11,9059 = 1,0079u
Bài 1.7 trang 4
Khi điện phân nước, người ta xác định được là ứng với 1 gam hiđro sẽ thu được 7,936 gam oxi.
Hỏi một nguyên tử oxi có khối lượng gấp bao nhiêu lần khối lượng của một nguyên tử hiđro?
Bài giải :
Phân tử nước H2O được cấu tạo bởi 2 nguyên tử H và một nguyên tử O.
Vậy khối lượng nguyên tử O gấp 15,872 (7,936 × 2) lần khối lượng nguyên tử H.
Bài 1.8 trang 4
Khi phóng chùm tia α vào một lá vàng mỏng, người ta thấy rằng trong khoảng 108 hạt α có một hạt gặp hạt nhân.
a) Một cách gần đúng, hãy xác định đường kính của hạt nhân so với đường kính của nguyên tử.
b) Với sự thừa nhận kết quả trên, hãy tính đường kính của nguyên tử nếu ta coi hạt nhân có kích thước như một quả bóng bàn có đường kính bằng 3 cm.
Bài giải :
a) Hat nhân như vây có tiết diên hình tròn bằng 1/108 tiết diên của nguyên tử. Vì đường kính tỉ lệ với căn bậc hai của diện tích hình tròn nên hạt nhân có đường kính vào khoảng 1/104 đường kính của nguyên tử.
b) Với giả thiết như đề bài thì đường kính nguyên tử sẽ là : 3.104 cm = 300 m.
Bài 1.9 trang 4
Nếu ta định nghĩa : “Một đơn vị cacbon (đvC) bằng 1/12 khối lượng của một nguyên tử cacbon” thì có chính xác không ? Vì sao ?
Bài giải :
Vì nguyên tố cacbon là một hỗn hợp đồng vị 12C, 13C … cho nên nguyên tử khối trung bình của cacbon là 12,0111 (chứ không phải chính xác là 12). Nếu lấy đơn vị cacbon theo định nghĩa nêu trong câu hỏi thì đơn vị đó sẽ lớn hơn đơn vị cacbon theo định nghĩa như sau :
“Môt đơn vi cacbon bằng 1/12 khối lượng của môt nguyên tử cacbon 12C”
Tuy nhiên, vì sự khác nhau không lớn, nên định nghĩa trên không sai mà chỉ thiếu chính xác.
Bài 1.10 trang 4
Xác định khối lượng riêng của hạt nhân nguyên tử hiđro, coi nó như một khối cầu có bán kính là 1.10-15 m. So sánh với urani là chất có khối lượng riêng bằng 19.103 kg/m3
Bài giải :
Thể tích của hạt nhân nguyên tử hiđro là :
V = 4/3 πr3 = 4/3. 3,14. (10-3)3 cm3 ≈ 4.10-39 cm3
Khối lượng riêng của hạt nhân nguyên tử hiđro là :
≈ 1 / 4.10-39 = 0,25.1039 u/cm3 hay 0,25.1039.1,66.10-24 gam/cm3
≈ 4,15.1014 gam/cm3 hay 4,15.1011 kg/cm3 hay 4,15.108 tấn/cm3
Khối lượng riêng của urani là 19.1013 kg/m3
So với khối lượng riêng của hạt nhân nguyên tử hidro thì khối lượng riêng của nguyên tử urani không đáng kể.
Bài 1.11 trang 4
Một loại tinh thể nguyên tử, có khối lượng riêng là 19,36 g/cm3. Trong đó, các nguyên tử chỉ chiếm 74% thể tích của tinh thể, còn lại là các khe rỗng. Bán kính của nguyên tử là 1,44Å.
a) Tính khối lượng riêng của nguyên tử, từ đó suy ra khối lượng mol nguyên tử.
b) Hạt nhân nguyên tử có 118 nơtron, nguyên tử khối được coi bằng tổng khối lượng proton và nơtron. Tính số proton.
Bài giải :
a) Khối lượng riêng của nguyên tử là :
D = 19,36 x 74% = (19,36 x 100) / 74 = 26,16 (g/cm3)
Khối lượng của 1 mol nguyên tử :
M = V.D.N = 4/3πr3.D.N = 4/3. 3,14. (1,44.10-8)3. 26,16. 6,022.1023 ≈ 197 (g/mol)
b) Nguyên tử khối là 197.
Ta có : nguyên tử khối ≈ số khối = P + N
Số proton = 197 – 118 = 79.
Đây là nội dung tóm tắt và giải bài tập Chương 1 bài 1: Thành phần nguyên tử của chương trình hóa học lớp 10 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 10