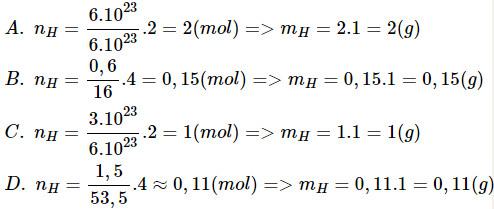Tóm tắt và giải hóa lớp 8 bài 31: Tính chất – Ứng dụng của hiđro
Tóm tắt và giải hóa lớp 8 bài 31: Tính chất – Ứng dụng của hiđro
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 31 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 8 bài 31:
– Kí hiệu của nguyên tố hiđro là H. Nguyên tử khối bằng 1.
Công thức hóa học của đơn chất hiđro là H2. Phân tử khối bằng 2.
– Hiđro là chất khí nhẹ nhất trong các chất khí.
– Khí hiđro có tính khử, ở nhiệt độ thích hợp, hiđro không những kết hợp được với đơn chất oxi, mà nó còn có thể kết hợp được với nguyên tố oxi trong một số oxit bazơ. Các phản ứng này đều tỏa nhiều nhiệt.
– Hiđro có ứng dụng, chủ yếu do tính chất rất nhẹ, do tính khử và khi cháy tỏa nhiều nhiệt.
2. Hướng dẫn giải bài tập Hóa học 8 bài 31:
Bài 1 trang 109
Viết phương trình hóa học của các phản ứng hiđro khử các oxit sau:
a) Sắt (III) oxit b) Thủy ngân (II) oxit c) Chì (II) oxit.
Bài giải:
a) Fe2O3 + 3H2 2Fe + 3H2O
b) HgO + H2 Hg + H2O
c) PbO + H2 Pb + H2O
Bài 2 trang 109
Hãy kể những ứng dụng của hidro mà em biết.
Bài giải:
– Dùng làm nhiên liệu cho động cơ tên lửa, có thể làm nhiên liệu cho động cơ ô tô thay cho xăng, dùng trong đèn xì oxi – hidro để hàn cắt kim loại. Đó là vì khí hiđro cháy, sinh ra một lượng nhiệt lớn hơn nhiều lần so với cùng lượng nhiên liệu khác.
– Là nguồn nhiên liệu trong sản xuất amoniac, axit và nhiều hợp chất hữu cơ.
– Dùng làm chất khử để điều chế một số kim loại từ oxit của chúng.
– Hiđro được dùng để bơm vào khinh khí cầu, bóng thám không vì là khí nhẹ nhất.
Bài 3 trang 109
Chọn cụm từ cho thích hợp trong khung để điền vào chỗ trống trong các câu sau :
| tính oxi hóa | tính khử | chiếm oxi | nhường oxi | nhẹ nhất |
Trong các chất khí, hiđro là khí…………Khí hiđro có……………..
Trong phản ứng giữa H2 và CuO, H2 là………….vì…………của chất khác ; CuO có…………vì ………cho chất khác.
Bài giải:
Trong các chất khí, hiđro là khí nhẹ nhất. Khí hiđro có tính khử.
Trong phản ứng giữa H2 và CuO, H2 có tính khử vì chiếm oxi của chất khác ; CuO có tính oxi hoá vì nhường oxi cho chất khác.
Bài 4 trang 109
Khử 48 gam đồng (II) oxit bằng khí hiđro. Hãy:
a. Tính số gam đồng kim loại thu được;
b. Tính thể tích khí hiđro (đktc) cần dùng.
Bài giải:
Số mol CuO là:
nCuO = mCuO / MCuO = 48/80 = 0,6 (mol)
Phương trình hóa học của phản ứng khử CuO:
CuO + H2 H2O + Cu
1 mol 1 mol 1 mol 1 mol
0,6 mol → 0,6 mol → 0,6 mol
a. Khối lượng đồng kim loại thu được:
mCu = nCu x MCu = 0,6 x 64 = 38,4 (g)
b. Thể tích khí hiđro (đktc) cần dùng :
VH2 = nH2 x 22,4 = 0,6 x 22,4 = 13,44 (lít)
Bài 5 trang 109
Khử 21,7 gam thủy ngân (II) oxit bằng hiđro. Hãy:
a. Tính số gam thủy ngân thu được;
b. Tính số mol và thể tích khí hiđro (đktc) cần dùng.
Bài giải:
Số mol HgO là :
nHgO = mHgO / MHgO = 21,7/217 = 0,1 (mol)
Phương trình hóa học của phản ứng :
HgO + H2 Hg + H2O
1 mol 1 mol 1 mol 1mol
0,1 mol → 0,1 mol → 0,1 mol
a. Khối lượng thủy ngân thu được :
mHgO = nHgO x MHgO = 0,1 x 201 = 20,1 (g)
b. Thể tích khí hiđro cần dùng ở đktc là:
VH2 = nH2 x 22,4 = 22,4 x 0,1 = 2,24 (lít)
Bài 6 trang 109
Tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít khí oxi (các thể tích khí đo ở đktc).
Bài giải:
nH2 = VH2 / 22,4 = 8,4/22,4 = 0,375 (mol)
nO2 = VO2 / 22,4 = 2,8/22,4 = 0,125 (mol)
Phương trình phản ứng :
2H2 + O2 → 2H2O
Tỉ lệ : 0,375/2 > 0,125/1 ⇒ H2 dư, O2 hết ⇒ Tính theo số mol O2.
Theo phương trình, ta có:
nH2O = 2nO2 =2 x 0,125 = 0,25 (mol)
mH2O = mH2O x MH2O = 0,25 x 18 = 4,5 (g)
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 8 bài 31:
Bài 31.1 trang 43
Phát biểu nào sau đây đúng ?
A. Hỗn hợp hiđro và oxi theo tỉ lệ 1 thể tích khí hiđro và 2 thể tích khí oxi là hỗn hợp nổ mạnh nhất.
B. Hỗn hợp hiđro và oxi theo tỉ lệ thể tích bằng nhau là hỗn hợp nổ mạnh nhất.
C. Hỗn hợp hiđro và oxi theo tỉ lệ 2 thể tích khí hiđro và 1 thể tích khí oxi là hỗn hợp nổ mạnh nhất.
D. Hiđro cháy mãnh liệt trong oxi nên gầy tiếng nổ mạnh.
Bài giải:
2H2 + O2 2H2O
Hỗn hợp hiđro và oxi theo tỉ lệ 2 thể tích khí hiđro và 1 thể tích khí oxi là hỗn hợp nổ mạnh nhất.
⇒ Chọn đáp án C.
Bài 31.2 trang 43
Phát biểu không đúng là :
A. Hiđro có thể kết hợp với nguyên tố oxi trong một số oxit kim loại.
B. Hiđro có thể tác dụng với một số oxit kim loại ở nhiệt độ cao.
C. Hiđro có nhiều ứng dụng, chủ yếu do tính chất nhẹ, có tính khử và khi cháy toả nhiều nhiệt.
D. Hiđro có thể tác dụng với tất cả oxit kim loại ở nhiệt độ cao.
Bài giải:
⇒ Chọn đáp án D.
Vì Hiđro có thể tác dụng với một số oxit kim loại ở nhiệt độ cao.
Bài 31.3 trang 43
Trường hợp chứa một khối lượng hiđro ít nhất là
A. 6.1023 phân tử H2 B. 0,6 g CH4
C. 3.1023 phân tử H2O D. 1,50 g NH4Cl
Bài giải:
⇒ Chọn đáp án D.
Bài 31.4 trang 43
Hỗn hợp khí H2 và khí O2 khi cháy lại gây tiếng nổ vì
A. hiđro cháy mãnh liệt trong oxi.
B. phản ứng này toả nhiều nhiệt
C. thể tích nước mới tạo thành bị dãn nở đột ngột, gây ra sự chấn động không khí, đó là tiếng nổ mà ta nghe được.
D. hiđro và oxi là hai chất khí, nên khi cháy gây tiếng nổ.
Bài giải:
Hỗn hợp khí H2 và khí O2 khi cháy lại gây tiếng nổ vì thể tích nước mới tạo thành bị dãn nở đột ngột, gây ra sự chấn động không khí, đó là tiếng nổ mà ta nghe được.
⇒ Chọn đáp án C.
Bài 31.5 trang 44
Trong vỏ Trái Đất, hiđro chiếm 1% về khối lượng và silic chiếm 26% về khối lượng. Hỏi nguyên tố nào có nhiều nguyên tử hơn trong vỏ Trái Đất ?
Bài giải:
Đặt khối lượng vỏ trái đất là a (gam) :
mH = a/100 (g) → nH = a / 100×1 (mol)
mSi = 26a/100 (g) → nSi = 26a / 100×28 (mol)
nH / nSi = (a/100) x (28×100 / 26a) = 28/26 = 14/13
⇒ nH = 14/13nSi
Vậy số nguyên tử của hiđro nhiều hơn số nguyên tử của sillic.
Bài 31.6 trang 44
Để điều chế hiđro người ta cho …………. tác dụng với Fe. Phản ứng này sinh ra khí ……………….. hiđro cháy cho …………. sinh ra rất nhiều …………. Trong trường hợp này chất cháy là …………….. chất duy trì sự cháy là ……………. Phương trình hoá học của phản ứng cháy :
…………….. + …………….. → ……………..
Bài giải:
Để điều chế hiđro người ta cho dung dịch axit HCl tác dụng với Fe. Phản ứng này sinh ra khí hiđro, hiđro cháy cho phân tử nước sinh ra rất nhiều nhiệt . Trong trường hợp này chất cháy là hiđro chất duy trì sự cháy là oxi. Phương trình hoá học của phản ứng cháy :
2H2 + O2 2H2O
Bài 31.7 trang 44
Có các khí: SO2, O2, N2, CO2, CH4
a) Những khí trên nặng hay nhẹ hơn khí hiđro bao nhiêu lần ?
b) Những khí trên nặng hay nhẹ hơn không khí bao nhiêu lần ?
Bài giải:
a) Những khí trên đều nặng hơn H2 :
dSO2/H2 = MSO2 / MH2 = 64/2 = 32 ⇒ Vậy khí SO2 nặng hơn khí H2 32 lần
dO2/H2 = MO2 / MH2 = 32/2 = 16 ⇒ Vậy khí O2 nặng hơn khí H2 16 lần
dN2/H2 = MN2 / MH2 = 28/2 = 14 ⇒ Vậy khí N2 nặng hơn khí H2 14 lần
dCO2/H2 = MCO2 / MH2 = 44/2 = 22 ⇒ Vậy khí CO2 nặng hơn khí H2 22 lần
dCH4/H2 = MCH4 / MH2 = 16/2 = 8 ⇒ Vậy khí CH4 nặng hơn khí H2 8 lần
b) Những khí nặng hơn không khí :
dSO2/kk = MSO2 / Mkk = 64/29 = 2,2 ⇒ Vậy khí SO2 nặng hơn không khí 2,2 lần
dO2/kk = MO2 / Mkk = 32/29 = 1,1 ⇒ Vậy khí O2 nặng hơn không khí 1,1 lần
dCO2/kk = MCO2 / Mkk = 44/29 = 1,5 ⇒ Vậy khí CO2 nặng không khí 1,5 lần
Những khí nhẹ hơn không khí :
dN2/kk = MN2 / Mkk = 28/29 = 0,96 ⇒ Vậy khí N2 nhẹ hơn không khí 0,96 lần
dCH4/kk = MCH4 / Mkk = 16/29 = 0,55 ⇒ Vậy khí CH4 nhẹ hơn không khí 0,55 lần
Bài 31.8 trang 44
Có một hỗn hợp gồm 60% Fe2O3 và 40% CuO về khối lượng. Người ta dùng H2 (dư) để khử 20 g hỗn hợp đó.
a) Tính khối lượng Fe và khối lượng Cu thu được sau phản ứng.
b) Tính số mol H2 đã tham gia phản ứng.
Bài giải:
Khối lượng Fe2O3 trong 20 g hỗn hợp :
mFe2O3 = 20 x 60% = (20 x 60)/100 = 12 (g)
⇒ nFe2O3 = mFe2O3 / MFe2O3 = 12 / 160 = 0,075 (mol)
Khối lương CuO trong 20 g hỗn hợp :
mCuO = mhh – mFe2O3 = 20 – 12 = 8 (g)
⇒ nCuO = mCuO / MCuO = 8/80 = 0,1 (mol)
Phương trình hóa học :
CuO + H2 H2O + Cu (1)
1 mol 1 mol 1 mol 1 mol
0,6 mol → 0,1 mol → 0,1 mol
Fe2O3 + 3H2 3H2O + 2 Fe (2)
1 mol 3 mol 3 mol 2 mol
0,075 mol → 0,225 mol → 0,15 mol
a) Theo phương trình hóa học trên :
Khối lượng Fe và khối lượng Cu thu được sau phản ứng là :
mCu = nCu x MCu = 0,1 x 64 = 6,4 (g)
mFe = nFe x MFe = 0,15 x 56 = 8,4 (g)
b) Số mol H2 tham gia phản ứng :
nH2 = nH2(1) + nH2(2) = 0,1 + 0,225 = 0,325 (mol)
Bài 31.9 trang 44
Trong các dịp lễ hội, em thường thấy các trường thả bóng. Những quả bóng đó có thể được bơm bằng những khí gì ? Em hãy giải thích vì sao khi bơm các khí đó thì quả bóng bay lên được, còn bơm không khí vào bóng thì bóng không bay được.
Bài giải:
Trong các dịp lễ hội, người ta thường thả bóng, những quả bóng thường được bơm bằng khí hiđro. Từ tỉ khối của hiđro so với không khí, ta thấy : Khí hiđro nhẹ xấp xỉ bằng 1/15 không khí nên bóng bay được.
Khi bơm không khí thì bóng không bay được vì không khí cộng với khối lượng quả bóng sẽ lớn hơn khối lượng không khí, nên bóng không được đẩy lên.
Bài 31.10 trang 44
Người ta dùng khí hiđro hoặc khí cacbon oxit để khử sắt (III) oxit thành sắt. Để điều chế 35 g sắt, thể tích khí hiđro và thể tích khí cacbon oxit lần lượt là (các khí đo ở đktc)
A. 42 lít và 21 lít B. 42 lít và 42 lít
C. 10,5 lít và 21 lít D. 21 lít và 21 lít
Bài giải:
Số mol Fe là :
nFe = mFe / MFe = 35/56 = 0,625 (mol)
Phương trình hóa học :
Fe2O3 + 3H2 3H2O + 2 Fe
1 mol 3 mol 3 mol 2 mol
0,9375 mol ← 0,625 mol
Fe2O3 + 3CO 3CO2 + 2 Fe
1 mol 3 mol 3 mol 2 mol
0,9375 mol ← 0,625 mol
Theo phương trình hóa học trên,thể tích khí hiđro và thể tích khí cacbon oxit lần lượt là :
VH2 = nH2 x 22,4 = 0,9375 x 22,4 = 21 (lít)
VCO = nCO x 22,4 = 0,9375 x 22,4 = 21 (lít)
⇒ Chọn đáp án D.
Bài 31.11 trang 44
Có 4 bình đựng riêng các khí sau : không khí, khí oxi, khí hiđro, khí cacbonic. Bằng cách nào để nhận biết các chất khí trong mỗi lọ ? Giải thích và viết các phương trình hoá học (nếu có)
Bài giải:
Lấy từng chất một mẫu thử :
Cho lần lượt từng mẫu thử trên qua dung dịch nước vôi trong Ca(OH)2 dư, mẫu thử nào làm đục nước vôi trong đó là CO2.
Phương trình hoá học :
Ca(OH)2 + CO2 → CaCO3 + H2O
Lấy que đóm đầu có than hồng cho vào các mẫu thử còn lại, mẫu thử nào làm than hồng bùng cháy đó là O2.
Cho mẫu thử còn lại qua CuO nung nóng, khí nào làm xuất hiện Cu (màu đỏ). Đó là H2. Mẫu thử còn lại là không khí không làm đổi màu CuO.
Phương trình hoá học :
CuO + H2 → Cu + H2O
Đây là nội dung tóm tắt và giải bài tập Chương 5 bài 31: Tính chất – Ứng dụng của hiđro trong chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8