Tóm tắt và giải hóa lớp 8 bài 44: Bài luyện tập 8
Tóm tắt và giải hóa lớp 8 bài 44: Bài luyện tập 8
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 44 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 8 bài 44 :
– Độ tan (S) của một chất là số gam chất đó tan được trong 100 g nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
– Nói chung độ tan của chất rắn sẽ tăng nếu tăng nhiệt độ. Độ tan của chất khí sẽ tăng nếu giảm nhiệt độ và tăng áp suất.
– Nồng độ phần trăm cho biết số gam chất tan có trong 100 g dung dịch :
C% = (mct / mdd) x 100%
– Nồng độ mol cho biết số mol chất tan trong một lít dung dịch :
CM = n / V (mol/l)
– Để pha chế một dung dịch theo nồng độ cho trước, ta thực hiện hai bước sau :
Bước 1 : Tính các đại lượng cần dùng.
Bước 2 : Pha chế dung dịch theo các đại lượng đã xác định.
2. Hướng dẫn giải bài tập Hóa học 8 bài 44 :
Bài 1 trang 151
Các kí hiệu sau cho chúng ta biết những điều gì ?
a) SKNO3(20oC) = 31, 6 g SKNO3(100oC) = 246 g
SCuSO4(20oC) = 20,7 g SCuSO4(100oC) = 75,4 g
b)SCO2(20oC,1atm) = 1,73 g SCO2(60oC,1 atm) = 0,07 g
Bài giải :
a) Ở 20oC độ tan của KNO3 là 31,6 g.
Ở 100oC độ tan của KNO3 là 246 g.
Ở 20oC độ tan của CuSO4 là 20,7 g.
Ở 100oC độ tan của CuSO4 là 75,4 g.
b) Ở 20oC và 1 atm độ tan của khí cacbonic là 1,73 g.
Ở 60oC và 1atm độ tan của khí cacbonic là 0,07 g.
Bài 2 trang 151
Bạn em đã pha loãng axit bằng cách rót từ từ 20 g dung dịch H2SO4 50% vào nước và sau đó thu được 50 g dung dịch H2SO4
a) Tính nồng độ phần trăm của dung dịch H2SO4 sau khi pha loãng.
b) Tính nồng độ mol của dung dịch H2SO4 sau khi pha loãng, biết dung dịch này có khối lượng riêng là 1,1 g/cm3.
Bài giải :
a) Khối lượng H2SO4 là :
mH2SO4 = 20 x 50% = 10 (g)
Nồng độ phần trăm dung dịch H2SO4 sau khi pha loãng là :
C% = (mct / mdd) x 100% = (10/50) x 100% = 20%
b) Số mol của H2SO4 là :
nH2SO4 = mH2SO4 / MH2SO4 = 10/98 = 0,102 (mol)
Thể tích của H2SO4 là :
V = mdd / D = 50/1,1 = 45,45 (ml) = 0,04545 (lít)
Nồng độ mol của dung dịch H2SO4 sau khi pha loãng :
CM = n / V = 0,102/0,04545 = 2,24 M
Bài 3 trang 151
Biết SK2SO4(20oC) = 11,1 g. Hãy tính nồng độ phần trăm của dung dịch K2SO4 bão hòa ở nhiệt độ này.
Bài giải :
Khối lượng dung dịch K2SO4 bão hòa ở nhiệt độ 20ºC là :
mdd = mct + mdm = 11,1 + 100 = 111,1 (g)
Nồng độ phần trăm của dung dịch K2SO4 bão hòa ở nhiệt độ 20ºC là :
C% = (mct / mdd) x 100% = (11,1/111,1) x 100% = 9,99%
Bài 4 trang 151
Trong 800 ml của một dung dịch có chứa 8 g NaOH.
a) Hãy tính nồng độ mol của dung dịch này.
b) Phải thêm bao nhiêu ml nước vào 200 ml dung dịch này để được dung dịch NaOH 0,1 M ?
Bài giải :
a) Số mol của NaOH là :
nNaOH = mNaOH / MNaOH = 8/40 = 0,2 (mol)
Ta có : 800 ml = 0,8 lít
Nồng độ mol của dung dịch là :
CM = n / V = 0,2/0,8 = 0,25 M
b. Số mol NaOH có trong 200 ml = 0,2 lít dung dịch NaOH 0,25 M :
nNaOH = CM x V = 0,25 x 0,2 = 0,05 (mol)
Thể tích dung dịch NaOH 0,1 M có chứa 0,05 mol NaOH :
V = n / CM = 0,05/0,1 = 0,5 lít = 500 ml
Vậy thể tích nước phải thêm là :
VH2O = 500 – 200 = 300 ml
Bài 5 trang 151
Hãy trình bày cách pha chế:
a) 400 g dung dịch CuSO4 4%.
b) 300 ml dung dịch NaCl 3M.
Bài giải :
a) Khối lượng chất tan CuSO4 là :
mCuSO4 = (mddCuSO4 x C%) / 100% = (400 x 4%) / 100% = 16 (g)
Khối lượng H2O là :
mH2O = mdd – mct = 400 – 16 = 384 g
Cách pha chế :
- Cân lấy 16 g CuSO4 khan (màu trắng) cho vào cốc có dung tích 100 ml.
- Cân lấy 384 g nước cất rồi đổ dần dần vào cốc.
- Khuấy kĩ cho CuSO4 tan hết, ta được 400 g dung dịch CuSO4 4%
b) Ta có : 300 ml = 0,3 lít
Số mol chất tan:
n = CM x V = 3 x 0,3 = 0,9 (mol)
Khối lượng của 0,9 mol NaCl :
mNaCl = 0,9 x 58,5 = 52,65 g
Cách pha chế:
- Cân lấy 52,65 g NaCl cho vào cốc thủy tinh.
- Đổ dần dần nước cất vào và khuấy nhẹ đủ 300 ml, ta được 300 ml dung dịch NaCl 3M
Bài 6 trang 151
Hãy trình bãy cách pha chế:
a) 150 g dung dịch CuSO4 2% từ dung dịch CuSO4 20%.
b) 250 ml dung dịch NaOH 0,5 M từ dung dịch NaOH 2M.
Bài giải :
a) Khối lượng chất tan có trong 150 g dung dịch CuSO4 2% :
mCuSO4 = (mddCuSO4 x C%) / 100% = (150 x 2%) / 100% = 3 (g)
Khối lượng dung dịch CuSO4 ban đầu có chứa 3 g CuSO4 :
mdd = (mct / C%) x 100% = (3 / 20%) x 100% = 15 (g)
Khối lượng nước cần pha chế là :
mnước = 150 – 15 = 135 (g)
Pha chế :
Lấy 15 g dung dịch CuSO4 20% vào cốc thêm 135 g H2O vào và khuấy đều, được 150 g dung dịch CuSO4 2%.
b) Ta có : 250 ml = 0,25 lít
Số mol chất tan trong 250 ml dung dịch NaOH 0,5M :
n = CM x V = 0,5 x 0,25 = 0,125 (mol)
Thể tích dung dịch NaOH 2M có chứa 0,125 mol NaOH là :
V = n / CM = 0,125/2 = 0,0625 lít = 62,5 ml
Pha chế :
- Đong lấy 62,5 ml dung dịch NaOH 2M cho vào cốc chia độ có dung tích 500 ml.
- Thêm từ từ nước cất vào cốc đến vạch 250 ml và khuấy đều ta được 250 ml dung dịch 0,5M.
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 8 bài 44 :
Bài 44.1 trang 60
Cân 10,6 g muối Na2CO3 cho vào cốc chia độ. Rót vào cốc khoảng vài chục mililít nước cất, khuấy cho muối tan hết. Sau đó rót thêm nước vào cốc cho đủ 200 ml. Ta được dung dịch Na2CO3 có khối lượng riêng là 1,05 g/ml. Hãy tính nồng độ phần trăm và nồng độ mol của dung dịch vừa pha chế.
Bài giải :
Khối lượng của dung dịch Na2CO3 :
mdd = D x V = 1,05 x 200 = 210 (g)
Nồng độ phần trăm của dung dịch :
C% = (mct / mdd) x 100% = (10,6/210) x 100% ≈ 5,05%
Số mol Na2CO3 trong dung dịch :
n = m / M = 10,6/106 = 0,1 (mol)
Nồng độ mol của dung dịch :
CM = n / V = 0,1/0,2 = 0,5 M
Bài 44.2 trang 60
Có : CuSO4 và nước cất. Hãy tính toán và trình bày cách pha chế để có được những sản phẩm sau :
a) 50 ml dung dịch CuSO4 có nồng độ 1M.
b) 50 g dung dịch CuSO4 có nồng độ 10%.
Bài giải :
a) Ta có : 50ml = 0,05 lít
Số mol CuSO4 cần dùng là :
n = CM x V = 1 x 0,05 = 0,05 (mol)
Khối lượng CuSO4 cần dùng là :
m = n x M = 0,05 x 160 = 8 (g)
Cách pha chế :
- Cân 8 g CuSO4 cho vào cốc chia độ.
- Thêm khoảng 25 – 30 ml nước cất vào cốc, dùng đũa thuỷ tinh khuấy cho CuSO4 tan hết, thêm từ từ nước cất cho đủ 50 ml.
- Trộn đều, ta được 50 ml dung dịch CuSO4 có nồng độ 1M.
b) Khối lượng CuSO4 cần dùng là :
mCuSO4 = (mdd x C%) / 100% = (50 x 10%) / 100% = 5 (g)
mnước = 50 – 5 = 45 (g)
Cách pha chế :
- Cân lấy 5 g CuSO4 cho vào cốc.
- Rót từ từ vào cốc 45 ml nước cất, khuấy cho CuSO4 tan hết, ta được 50 g dung dịch CuSO4 10%.
Bài 44.3 trang 60
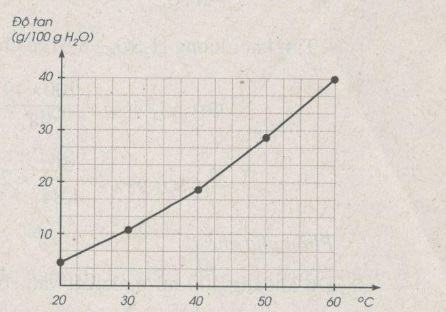
Bảng dưới đây cho biết độ tan của một muối trong nước thay đổi theo nhiệt độ :
| Nhiệt độ (°C) | 20 | 30 | 40 | 50 | 60 |
| Độ tan (g/100g nước) | 5 | 11 | 18 | 28 | 40 |
a) Vẽ đồ thị biểu diễn độ tan của muối trong nước (trục tung biểu thị khối lượng chất tan, trục hoành biểu thị nhiệt độ).
b) Căn cứ vào đồ thị, hãy ước lượng độ tan của muối ở 25°C và 55°C.
c) Tính số gam muối tan trong :
– 200 g nước để có dung dịch bão hoà ở nhiệt độ 20°C.
– 2 kg nước để có dung dịch bão hoà ờ nhiệt độ 50°C.
Bài giải :
a) Đồ thị :
b) Ước lượng độ tan của muối :
S25°C ≈ 7,5 g/100g H2O
S55°C ≈ 32 g/100g H2O
c) Số gam muối tan :
– Ở 20°C thì độ tan của muối là 5 g.
Vậy trong 200 g nước muối tan có khối lượng :
(5 x 200) / 100 = 10 (g)
– Ở 50°C thì độ tan của muối là 28 g.
Vậy trong 2 kg = 2000g nước muối tan có khối lượng :
(2000 x 28) / 100 = 560 (g)
Bài 44.4 trang 60
Người ta pha chế một dung dịch NaCl ở 20°C bằng cách hoà tan 23,5 g NaCl trong 75 g nước. Căn cứ vào độ tan của NaCl trong nước SNaCl(20°C) = 32 (g), hãy cho biết dung dịch NaCl đã pha chế là bão hoà hay chưa bão hoà. Nếu dung dịch NaCl là chưa bão hoà, làm thế nào để có được dung dịch NaCl bão hoà ở 20°C ?
Bài giải :
Theo độ tan của muối NaCl trong nước ở nhiệt độ 20°C là 32 g, ở nhiệt độ này 75 g nước hoà tan tối đa được :
m = (32 x 75) / 100 = 24 (g)
Vậy dung dịch NaCl đã pha chế là chưa bão hòa. Để dung dịch NaCl bão hòa ở nhiệt độ này, ta cần cho thêm vào dung dịch đã pha chế một lượng NaCl là:
24 – 23,5 = 0,5 (g)
Khuấy cho muối tan hết, ta được dung dịch bão hoà NaCl ở 20°C.
Bài 44.5 trang 61
Hãy tính toán và trình bày cách pha chế 0,5 lít dung dịch H2SO4 có nồng độ 1M từ H2SO4 có nồng độ 98%, khối lượng riêng là 1,84 g/ml.
Bài giải :
Số mol của H2SO4 cần để pha chế 500ml dung dịch H2SO4 1M :
nH2SO4 = CM x V = 1 x 0,5 = 0,5 (mol)
⇒ mH2SO4 = n x M = 0,5 x 98 = 49 (g)
Khối lượng H2SO4 98% có chứa 49 g H2SO4 :
mddH2SO4 = (mH2SO4 / C%) x 100% = 49/98 x 100% = 50 (g)
Vdd = m / D = 50/1,84 ≈ 27,2 (ml)
Phần pha chế :
- Đổ khoảng 400 ml nước cất vào cốc chia độ có dung tích 1 lít.
- Rót từ từ 27,2 ml H2SO4 98% vào cốc, khuấy đều.
- Sau đó thêm dần dần nước cất vào cốc cho đủ 500 ml. Ta đã pha chế được 500 ml dung dịch H2SO4 1M.
Bài 44.6 trang 61
A là dung dịch H2SO4 có nồng độ 0,2M. B là dung dịch H2SO4 có nồng độ 0,5M.
a) Nếu trộn A và B theo tỉ lệ thể tích VA : VB = 2 : 3 được dung dịch C. Hãy xác định nồng độ mol của dung dịch C.
b) Phải trộn A và B theo tỉ lệ nào về thể tích để được dung dịch H2SO4 có nồng độ 0,3M ?
Bài giải :
a) Ta có: VA : VB = 2 : 3
Số mol H2SO4 có trong 2V (l) dung dịch A :
nH2SO4 = CM x VA = 0,2 x 2V = 0,4V (mol)
Số mol H2SO4 có trong 3V (l) dung dịch B :
nH2SO4 = CM x VB = 0,5 x 3V = 1,5V (mol)
Nồng độ mol của dung dịch H2SO4 sau khi pha trộn:
CM = n / V = (0,4V + 1,5V )/(2V + 3V) = 0,38 M
Vậy nồng độ mol của dung dịch C là 0,38 M.
b) Gọi x là thể tích của dung dịch axit A và y là thể tích của dung dịch B.
nH2SO4 (A) = CM x VA = 0,2x (mol)
nH2SO4 (B) = CM x VA = 0,5y (mol)
CM = n / V = (0,2x + 0,5y)/(x + y) = 0,3
⇒ x = 2y
Ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch H2SO4 có nồng độ 0,3M.
Bài 44.7 trang 61
Có 200 g dung dịch NaOH 5% (dung dịch A).
a) Cần phải trộn thêm vào dung dịch A bao nhiêu gam dung dịch NaOH 10% để được dung dịch NaOH 8% ?
b) Cần hoà tan bao nhiêu gam NaOH vào dung dịch A để có dung dịch NaOH 8% ?
c) Làm bay hơi nước dung dịch A, người ta cũng thu được dung dịch NaOH 8%. Tính khối lượng nước đã bay hơi.
Bài giải :
a) Khối lượng NaOH có trong dung dịch ban đầu :
mNaOH = (mdd x C%) / 100% = (200 x 5%) / 100% = 10 (g)
Đặt a (g) là khối lượng dung dịch NaOH 10% cần dùng.
mNaOH = (mdd x C%) / 100% = (a x 10%) / 100% = 0,1a (g)
Đề thu được dung dịch 8% ta có :
C% = (mct / mdd) x 100% ⇔ (10 + 0,1a)/(200 + a) x 100% = 8%
Giải phương trình, ta được : a = 300 (g)
Phải trộn thêm 300 g dung dịch NaOH 10% ta sẽ có 200 + 300 = 500 (g) dung dịch NaOH nồng độ 8%.
b) Đặt a (g) là khối lượng nước bay hơi khỏi dung dịch để có dung dịch NaOH nồng độ 8%.
Ta có :
C% = (mct / mdd) x 100% ⇔ (10 + a)/(200 + a) x 100% = 8%
Giải phương trình, ta được : a = 6,52 (g)
Phải trộn thêm 6,52 g NaOH vào dung dịch A ta sẽ được dung dịch NaOH nồng độ 8%.
c) Đặt a (g) là khối lượng nước bay hơi khỏi dung dịch để có dung dịch NaOH nồng độ 8%.
Ta có :
C% = (mct / mdd) x 100% ⇔ 10/(200 – a) x 100% = 8%
Giải phương trình, ta được : a = 75 (g)
Cho 75 g nước bay hơi ra khỏi 200 g dung dịch NaOH ban đầu, ta được 200 – 75 = 125 (g) dung dịch NaOH có nồng độ 8%.
Đây là nội dung tóm tắt và giải bài tập Chương 6 bài 44: Bài luyện tập 8 trong chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8