Tóm tắt và giải hóa lớp 8 bài 4: Nguyên tử
Tóm tắt và giải hóa lớp 8 bài 4: Nguyên tử
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 4 mà bạn có thể tham khảo để học hóa tốt hơn!
1. Tóm tắt hóa học lớp 8 bài 4:
– Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm.
– Hạt nhân nguyên tử tạo bởi proton (p) và nơtron (n).
– Nơtron không mang điện.
– Các nguyên tử cùng loại đều có cùng số proton trong hạt nhân.
– Trong mỗi nguyên tử, số proton (p,+) bằng số electron (e,-).
– Electron luôn chuyển động rất nhanh quanh hạt nhân và sắp xếp thành từng lớp. Mỗi lớp có số electron nhất định.
2. Hướng dẫn giải bài tập Hóa học bài 4:
Bài 1 trang 15:
Hãy chép các câu sau đây vào vở bài tập với đầy đủ các từ hay cụm từ thích hợp
“………là hạt vô cùng nhỏ, trung hòa về điện : từ …….. tạo ra mọi chất. Nguyên tử gồm…………… mang điện tích dương và vỏ tạo bởi …………..”
Lời giải:
“Nguyên tử là hạt vô cùng nhỏ, trung hòa về điện : từ nguyên tử tạo ra mọi chất. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm”.
Bài 2 trang 15:
a. Nguyên tử tạo thành từ ba loại hạt nhỏ hơn nữa (gọi là hạt dưới nguyên tử), đó là những hạt nào ?
Nguyên tử được tạo thành từ ba loại hạt dưới nguyên tử là: proton, electron, nơtron.
b. Hãy nói tên, kí hiệu và điện tích của những hạt mang điện.
Các hạt mang điện là:
Proton: kí hiệu là p, mang điện tích dương.
Electron: kí hiệu là e, mang điện tích âm.
| Tên | Proton | Electron |
| Kí hiệu | p | e |
| Điện tích | + 1 | – 1 |
c. Những nguyên tử cùng loại có cùng số hạt nào trong hạt nhân ?
Những nguyên tử cùng loại đều có cùng số proton trong hạt nhân.
Bài 3 trang 15:
Vì sao nói khối lượng của hạt nhân được coi là khối lượng của nguyên tử ?
Lời giải:
Khối lượng nguyên tử bao gồm khối lượng của hạt nhân và khối lượng của electron, nhưng khối lượng của electron rất bé, không đáng kể. Vì vậy, khối lượng của hạt nhân được coi là khối lượng của nguyên tử.
Bài 4 trang 15:
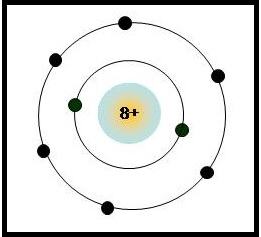
Trong nguyên tử, electron chuyển động và sắp xếp như thế nào ? Lấy thí dụ minh họa với nguyên tử oxi.
Lời giải:
– Trong nguyên tử, electron luôn chuyển động rất nhanh quanh hạt nhân và sắp xếp thành từng lớp, mỗi lớp có một số electron nhất định.
– Nguyên tử oxi có 8 electron chia hai lớp: lớp trong có 2 electron và lớp ngoài có 6 electron.
Mô hình nguyên tử oxi:
Bài 5 trang 16:
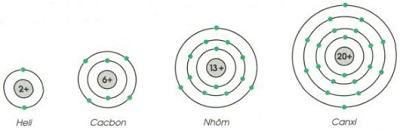
Cho biết sơ đồ một số nguyên tử sau:
Hãy chỉ ra: Số p trong hạt nhân, số e trong nguyên tử, số lớp electron và số e lớp ngoài cùng của mỗi nguyên tử.
| Nguyên tử | Số p trong hạt nhân | Số e trong nguyên tử | Số lớp electron | Số e lớp ngoài cùng |
| Heli | 2 | 2 | 1 | 2 |
| Cacbon | 6 | 6 | 2 | 4 |
| Nhôm | 13 | 13 | 3 | 3 |
| Canxi | 20 | 20 | 4 | 2 |
3. Hướng dẫn giải bài tập Sách bài tập hóa học bài 4:
Bài 4.1 trang 4:
Điền tên hạt nào tạo thành nguyên tử vào các câu sau đây (chép vào ở bài tập):
a) ……. và …. có điện tích như nhau, chỉ khác dấu.
b) ..…. và …. có cùng khối lượng, còn …. có khối lượng rất bé, không đáng kể.
c) Những nguyên tử cùng loại có cùng số …. trong hạt nhân.
d) Trong nguyên tử … luôn chuyển động rất nhanh và sắp xếp thành từng lớp.
Bài giải:
a) Electron và proton có điện tích như nhau, chỉ khác dấu.
b) Proton và nơtron có cùng khối lượng, còn electron có khối lượng rất bé, không đáng kể.
c) Những nguyên tử cùng loại có cùng số proton trong hạt nhân.
d) Trong nguyên tử các electron luôn chuyển động rất nhanh và sắp xếp thành từng lớp.
Bài 4.2 trang 5:
Có thể dùng các cụm từ sau đây để nói về nguyên tử:
A. Vô cùng nhỏ
B. Trung hòa về điện.
C. Tạo ra các chất.
D. Không chia nhỏ hơn trong phản ứng hóa học.
Hãy chọn cụm từ phù hợp (A, B, C hay D?) với phần còn lại trống trong câu:
“Nguyên tử là hạt …, vì số electron có trong nguyên tử bằng đúng số proton trong hạt nhân”.
Đáp án:
Chọn B.
Bài 4.3 trang 5:
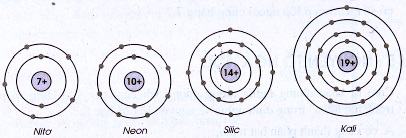
Cho biết sơ đồ một số nguyên tử sau:
Hãy chỉ ra số proton trong hạt nhân, số electron trong nguyên tử, số lớp electron và số electron lớp ngoài cùng của mỗi nguyên tử.
| Nguyên tử | Số p trong hạt nhân | Số electron trong nguyên tử | Số lớp electron | Số electron lớp ngoài cùng |
| Nitơ | 7 | 7 | 2 | 5 |
| Neon | 10 | 10 | 2 | 8 |
| Silic | 14 | 14 | 3 | 4 |
| Kali | 19 | 19 | 4 | 1 |
Bài 4.4 trang 5:
Theo sơ đồ một số nguyên tử ở bài tập 4.3, hãy chỉ ra:
a) Mỗi nguyên tử có mấy lớp electron.
| Nguyên tử | Số lớp electron |
| Nitơ | 2 |
| Neon | 2 |
| Silic | 3 |
| Kali | 4 |
b) Những nguyên tử nào có cùng một số lớp electron.
Nguyên tử có cùng số electron: nitơ, neon.
c) Nguyên tử nào có số lớp electron như nguyên tử natri. (xem sơ đồ trong Bai 4 – SGK).
Nguyên tử silic có cùng số lớp electron như nguyên tử natri. (Có 3 lớp electron)
Bài 4.5 trang 5
Yêu cầu như bài 4.4
a) Nguyên tử nào có số electron lớp ngoài cùng như nguyên tử natri.
Nguyên tử kali có số electron ngoài cùng như nguyên tử natri. (Có 1 electron lớp ngoài cùng)
b) Nguyên tử cacbon (xem sơ đồ trong bài tập 5, bài 4 – SGK) có số lớp electron như nguyên tử nào.
Nguyên tử cacbon có số lớp electron như nguyên tử nitơ và nguyên tử neon. (Có 2 lớp electron)
c) Nguyên tử nào có số electron lớp ngoài cùng như nguyên tử cacbon.
Nguyên tử silic có số electron lớp ngoài cùng như nguyên tử cacbon. (Có 4 electron lớp ngoài cùng)
Bài 4.6 trang 6:
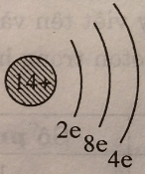
Có thể vẽ sơ đồ đơn giản gồm vòng tròn con là hạt nhân, mỗi vòng cung nhỏ là một lớp với số electron của lớp ghi ở chân. Thí dụ sơ đồ đơn giản của nguyên tử sillic trong bài tập 4.3 như sau:
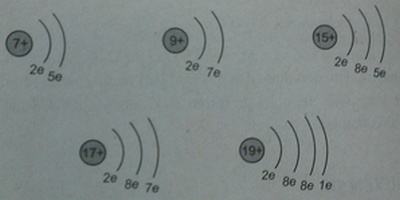
a. Vẽ sơ đồ đơn giản của năm nguyên tử mà trong hạt nhân có số proton bằng 7, 9, 15, 17, 19.
b. Mấy nguyên tử có số electron ở lớp ngoài cùng bằng 5, mấy nguyên tử có số electron ở lớp ngoài cùng bằng 7 ?
- Có hai nguyên tử có số electron ngoài cùng là 5
- Có hai nguyên tử có số electron ngoài cùng là 7
Đây là nội dung tóm tắt và giải bài tập Chương 1 bài 4: Nguyên tử của chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8