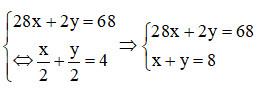Tóm tắt và giải hóa lớp 8 bài 38: Bài luyện tập 7
Tóm tắt và giải hóa lớp 8 bài 38: Bài luyện tập 7
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 38 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 8 bài 38:
– Nước là hợp chất tạo bởi hai nguyên tố là hiđro và oxi, chúng đã hóa hợp với nhau theo tỉ lệ thể tích là hai phần khí hiđro và một phần khí oxi.
– Nước là chất lỏng không màu, không mùi, không vị, sôi ở 100oC, hòa tan được nhiều chất rắn, lỏng, khí.
– Nước tác dụng với một số kim loại ở nhiệt độ thường (như Na, K, Ca, …) tạo thành bazơ và hiđro ; tác dụng với một số oxit bazơ tạo ra bazơ như NaOH, KOH ; tác dụng với một số oxit phi kim tạo ra axit.
– Phân tử axit gồm có một hay nhiều nguyên tử hiđro liên kết với gốc axit, các nguyên tử hiđro này có thể thay thế bằng nguyên tử kim loại.
Công thức hóa học của axit gồm một hoặc nhiều nguyên tử H và gốc axit.
– Phân tử bazơ gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (-OH).
Công thức hóa học của bazơ gồm một nguyên tử kim loại và một số nhóm -OH.
Tên bazơ : Tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + hiđroxit.
– Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit.
Công thức hóa học của muối gồm hai phần : kim loại và gốc axit.
Tên muối : Tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + tên gốc axit.
2. Hướng dẫn giải bài tập Hóa học 8 bài 38:
Bài 1 trang 131
Tương tự như natri, các kim loại kali K và canxi Ca cũng tác dụng được với nước tạo thành bazơ tan và giải phóng hiđro.
a) Hãy viết phương trình phản ứng hóa học xảy ra.
b) Các phản ứng hóa học trên thuộc loại phản ứng hóa học nào ?
Bài giải :
a) Phương trình phản ứng:
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
b) Phản ứng hóa học trên thuộc loại phản ứng thế.
Bài 2 trang 132
Hãy lập các phương trình hóa học của phản ứng có sơ đồ sau đây:
a) Na2O + H2O → NaOH
K2O + H2O → KOH
b) SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
N2O5 + H2O → HNO3
c) NaOH + HCl → NaCl + H2O
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
d)Chỉ ra loại chất tạo thành ở a), b), c) là gì ? Nguyên nhân có sự khác nhau ở a) và b)
e) Gọi tên các chất tạo thành.
Bài giải :
a) Na2O + H2O→ 2NaOH
K2O + H2O → 2KOH
b) SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
c) NaOH + HCl → NaCl + H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
d)
+ Loại chất tạo thành ở câu a gồm NaOH, KOH là bazơ.
+ Loại chất tạo thành ở câu b gồm H2SO4, H2SO3, HNO3 là axit.
+ Loại chất tạo thành ở câu c gồm NaCl, Al2(SO4)3 là muối.
Sự khác nhau giữa câu a và câu b là oxit của kim loại Na2O, K2O tác dụng với nước tạo thành bazơ. Còn oxit của phi kim SO2, SO3, N2O5 tác dụng với nước tạo thành axit.
e) Gọi tên các sản phẩm
NaOH: natri hiđroxit
KOH: kali hiđroxit
H2SO3: axit sunfurơ
H2SO4: axit sunfuric
HNO3: axit nitric
NaCl: natri clorua
Al2(SO4)3: nhôm sunfat
Bài 3 trang 132
Viết công thức hóa học của những muối có tên gọi dưới đây :
Đồng (II) clorua, kẽm sunfat, sắt (III) sunfat, magie hiđrocacbonat, canxi photphat, natri hiđrophotphat, natri đihiđrophotphat.
Bài giải :
Đồng (II) clorua: CuCl2
Kẽm sunfat: ZnSO4
Sắt (III) sunfat: Fe2(SO4)3
Magie hiđrocacbonat : Mg(HCO3)2
canxi photphat: Ca3(PO4)2
Natri hiđrophotphat: Na2HPO4
Natri đihiđrophotphat: NaH2PO4
Bài 4 trang 132
Cho biết khối lượng mol của một oxit của kim loại là 160 g/mol, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit đó.
Bài giải :
Đặt công thức của oxit kim loại là MxOy (x,y ∈ N*)
%mO = 100% – 70% = 30%
⇒ mO = 16y = 160 x 30% = 48
⇒ 16y = 48 ⇒ y = 3
Phân tử khối của kim loại M là :
mKL = 160 x 70% = 112 (g) ⇒ MKL . x = 112
→ Nếu x = 2 thì M = 56. Vậy M là Fe.
Vậy công thức hóa học của oxit kim loại là Fe2O3 (Sắt (III) oxit).
Bài 5 trang 132
Nhôm oxit tác dụng với axit sunfuric theo phương trình hóa học như sau:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính khối lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49 gam axit sunfuric nguyên chất tác dụng với 60 gam nhôm oxit. Sau phản ứng, chất nào còn dư ? Khối lượng dư của chất đó là bao nhiêu ?
Bài giải :
nH2SO4 = mH2SO4 / MH2SO4 = 49/98 = 0,5 (mol)
nAl2O3 = mAl2O3 / MAl2O3 = 60/102 = 0,59 (mol)
Phương trình hóa học của phản ứng :
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
1 mol 3 mol 1 mol 3 mol
0,5/3 mol ← 0,5 mol
So sánh tỉ lệ số mol :
0,59/1 > 0,5/3 ⇒ Vậy axit H2SO4 phản ứng hết, Al2O3 dư. Tính theo số mol H2SO4.
Khối lượng Al2O3 phản ứng là :
nAl2O3 pư = 0,5/3 (mol)
mAl2O3 pư = nAl2O3 pư x MAl2O3 = 0,5/3 x 120 = 17 (g)
Khối lượng Al2O3 dư là :
mAl2O3 dư = 60 – 17 = 43 (g)
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 8 bài 38:
Bài 38.1 trang 52
a) Lập phương trình hoá học của các phản ứng sau :
(1) Lưu huỳnh đioxit + nước (2) Sắt(III) oxit + hiđro
(3) Kẽm + dung dịch muối đồng(II) sunfat (4) Kẽm + axit sunfuric (loãng)
(5) Canxi oxit + nước
b) Các loại phản ứng trên thuộc loại phản ứng nào ?
Bài giải :
(1) SO2 + H2O → H2SO3 (Phản ứng hóa hợp)
(2) Fe2O3 + 3H2 → 2Fe + 3H2O (Phản ứng oxi hóa – khử)
(3) Zn + CuSO4 → Cu + ZnSO4 (Phản ứng thế)
(4) Zn + H2SO4 → ZnSO4 + H2 (Phản ứng thế)
(5) Ca + 2H2O → Ca(OH)2 + H2 (Phản ứng hóa hợp)
Bài 38.2 trang 52
Có những cụm từ : Sự cháy, phản ứng phân huỷ, phản ứng hoá hợp, phản ứng toả nhiệt. Hãy chọn những cụm từ thích hợp để điền vào những chỗ trống trong các câu sau :
a) …………là phản ứng hoá học, trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
b) ………….là phản ứng hoá học có sinh nhiệt trong quá trình xảy ra.
c) …………là phản ứng hoá học trong đó từ một chất sinh ra nhiều chất mới.
d) ………… là sự oxi hoá có toả nhiệt và phát sáng.
Đối với mỗi câu trên hãy dẫn ra một phương trình hoá học để minh hoạ.
Bài giải :
a) Phản ứng hoá hợp là phản ứng hoá học, trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
SO2 + H2O → H2SO3
b) Phản ứng toả nhiệt là phản ứng hoá học có sinh nhiệt trong quá trình xảy ra.
C + O2 CO2
c) Phản ứng phân huỷ là phản ứng hoá học trong đó từ một chất sinh ra nhiều chất mới.
CaCO3 CaO + CO2
d) Sự cháy là sự oxi hoá có toả nhiệt và phát sáng.
S + O2 SO2
Bài 38.3 trang 53
Từ những hoá chất cho sẵn : KMnO4, Fe, dung dịch CuSO4, dung dịch H2SO4 loãng, hãy viết các phương trình hoá học để điều chế các chất theo sơ đồ chuyển hoá sau : Cu → CuO → Cu. Biết Fe có thể phản ứng với CuSO4 theo phương trình : Fe + CuSO4 → Cu + FeSO4
Bài giải :
Các chất cần cho biến đổi hóa học này là Cu, O2 và H2.
Fe + H2SO4 → FeSO4 + H2
2KMnO4 O2 + MnO2 + K2MnO4
Fe + CuSO4 → FeSO4 + Cu
2Cu + O2 2CuO
CuO + H2 Cu + H2O
Bài 38.4 trang 53
Khi điện phân nước thu được 2 thể tích H2 và 1 thể tích khí O2 (cùng điều kiện nhiệt độ, áp suất). Từ kết quả này, em hãy chứng minh công thức hoá học của nước.
Bài giải :
Phương trình điện phân nước :
2H2O 2H2 + O2
2 mol 2 mol 1 mol
Trong cùng điều kiện nhiệt độ áp suất tỷ lệ thể tích bằng tỷ lệ mol, nên:
nH2 : nO2 = 2 : 1 ⇒ nH2 / nO2 = 2 / 1
Vậy công thức hóa học của nước là H2O.
Bài 38.5 trang 53
Để đốt cháy 68 g hỗn hợp khí hiđro và khí CO cần 89,6 lít oxi (ở đktc). Xác định thành phần phần trăm khối lượng của các khí trong hỗn hợp ban đầu. Nêu các phương pháp giải bài toán.
Bài giải :
* Phương pháp 1 :
Phương trình phản ứng :
2CO + O2 → 2CO2
2H2 + O2 → 2H2O
Số mol oxi là :
nO2 = VO2 / 22,4 = 89,6/22,4 = 4 (mol)
Từ các phương trình hóa học trên, ta nhận thấy:
2 mol hidro (hay CO) đều phản ứng với 1 mol oxi.
8 mol hỗn hợp phản ứng với 4 mol oxi.
Gọi số mol CO là x ; số mol H2 là (8 – x)
28x +2(8 – x) = 68
⇒ x = 2
%VCO = (2/8) x 100% = 25%
%VH2 = 100% – 25% = 75%
* Phương pháp 2 :
Số mol oxi là :
nO2 = VO2 / 22,4 = 89,6/22,4 = 4 (mol)
Gọi x là số mol của CO, y là số mol của H2
Theo đề bài: 28x + 2y = 68 (1)
Phương trình phản ứng:
2CO + O2 → 2CO2 (a)
2 mol 1 mol
x mol → x/2 mol
2H2 + O2 → 2H2O (b)
2 mol 1 mol
y mol → y/2 mol
nO2 = nO2(a) + nO2(b) = x/2 + y/2 = 4
Từ (1) và (2) ta có hệ phương trình :
Giải hệ phương trình, ta có: x = 2, y = 6.
%VCO = (2/8) x 100% = 25%
%VH2 = 100% – 25% = 75%
Bài 38.6 trang 53
Khử 50 g hỗn hợp đồng(II) oxit và sắt(II) oxit bằng khí hiđro. Tính thể tích khí hiđro cần dùng, biết rằng trong hỗn hợp, đồng(II) oxit chiếm 20% về khối lượng. Các phản ứng đó thuộc loại phản ứng gì ?
Bài giải :
Khối lượng đồng(II) oxit là :
mCuO = 50 x 20% = 10 (g)
nCuO = mCuO / MCuO = 10/80 = 0,125 (mol)
Khối lượng sắt(II) oxit là :
mFeO = 50 x 80% = 40 (g)
nFeO = mFeO / MFeO = 40/72 = 0,56 (mol)
Phương trình phản ứng :
FeO + H2 H2O + Fe (1)
1 mol 1 mol
0,56 mol → 0,56 mol
CuO + H2 H2O + Cu (2)
1 mol 1 mol
0,125 mol → 0,125 mol
Số mol hiđro cần dùng là :
nH2 = nH2(1) + nH2(2) = 0,56 + 0,125 = 0,685 (mol)
Thể tích khí hiđro cần dùng là :
VH2 = nH2 x 22,4 = 0,685 x 22,4 = 15,344 (lít)
Hai phản ứng trên là phản ứng oxi hóa – khử.
Bài 38.7 trang 53
Cho 0,2 mol kẽm tác dụng với dung dịch có chứa 49 gam axit sunfuric.
a) Viết phương trình hóa học.
b) Sau phản ứng chất nào còn dư.
c) Tính thể tích khí hiđro thu được (đktc).
Bài giải :
a) Phương trình hóa học :
Zn + H2SO4 → ZnSO4 + H2 ↑
b) Số mol H2SO4 là :
nH2SO4 = mH2SO4 / MH2SO4 = 49/98 = 0,5 (mol)
Ta có tỷ lệ số mol Zn và H2SO4 là :
0,2/1 < 0,5/1
→ Vậy sau phản ứng H2SO4 dư, Zn hết.
c) Thể tích khí hiđro thu được theo số mol kim loại kẽm :
nZn = nH2 = 0,2 (mol)
VH2 = nH2 x 22,4 = 0,2 x 22,4 = 4,48 (lít)
Bài 38.8 trang 53
Tính Trong phòng thí nghiệm có các kim loại Al, Fe và dung dịch HCl.
a) Cho cùng một khối lượng các kim loại trên tác dụng hết với dung dịch HCl thì kim loại nào cho khí hiđro nhiều hơn ?
b) Nếu thu được cùng một lượng khí hiđro thì khối lượng kim loại nào dùng ít hơn ?
Bài giải :
Gọi a là khối lượng của các kim loại cùng tác dụng với HCl.
Phương trình phản ứng :
2Al + 6HCl → 2AlCl3 + 3H2 ↑
2 x 27 (g) 3 x 22,4 (lít)
a (g) → x (lít)
Số mol H2 là : x = (3 x 22,4).a / (2 x 27) = 1,24a
Fe + 2HCl → FeCl2 + H2 ↑
56 (g) 22,4 (lít)
a (g) → y (lít)
Số mol H2 là : y = 22,4a / 56 = 0,4a
Vậy x > y → Cùng một lượng Al và Fe tác dụng hết với dung dịch HCl thì Al cho thể tích hiđro nhiều hơn sắt.
b) Nếu thu được cùng một lượng khí hiđro thì lượng Al dùng ít hơn lượng Fe.
Bài 38.9 trang 53
Dùng khí H2 để khử hết 50 g hỗn hợp A gồm đồng(II) oxit và sắt(III) oxit. Biết trong hỗn hợp sắt(III) oxit chiếm 80% khối lượng. Thể tích khí H2 (đktc) cần dùng là
A. 29,4 lít. B. 9,8 lít. C. 19,6 lít. D. 39,2 lít.
Bài giải :
Khối lượng đồng(II) oxit là :
mCuO = 50 x 20% = 10 (g)
nCuO = mCuO / MCuO = 10/80 = 0,125 (mol)
Khối lượng sắt(III) oxit là :
mFe2O3 = 50 x 80% = 40 (g)
nFe2O3 = mFe2O3 / MFe2O3 = 40/162 = 0,25 (mol)
Phương trình phản ứng :
Fe2O3 + 3H2 3H2O + 2Fe (1)
1 mol 3 mol
0,25 mol → 0,75 mol
CuO + H2 H2O + Cu (2)
1 mol 1 mol
0,125 mol → 0,125 mol
Số mol hiđro cần dùng là :
nH2 = nH2(1) + nH2(2) = 0,75 + 0,125 = 0,875 (mol)
Thể tích khí hiđro cần dùng là :
VH2 = nH2 x 22,4 = 0,875 x 22,4 = 19,6 (lít)
⇒ Chọn đáp án C.
Bài 38.10 trang 53
Viết công thức hoá học của các muối sau đây :
a) Canxi clorua ; b) Kali clorua ; c) Bạc nitrat;
d) Kali sunfat; đ) Magie nitrat; e) Canxi sunfat.
Bài giải :
a) Canxi clorua : CaCl2
b) Kali clorua : KCl
c) Bạc nitrat : AgNO3
d) Kali sunfat : K2SO4
đ) Magie nitrat : Mg(NO3)2
e) Canxi sunfat : CaSO4
Bài 38.11 trang 53
a) Cho 13 g kẽm tác dụng với 0,3 mol HCl, khối lượng muối ZnCl2 được tạo thành trong phản ứng này là
A. 20,4 g. B. 10,2 g.
C. 30,6 g. D. 40 g
b) Có thể nói trong HCl có các đơn chất hiđro và clo được không ? Tại sao ?
Bài giải :
a) Số mol Zn là :
nZn = mZn / MZn = 13/65 = 0,2 (mol)
Phương trình phản ứng :
Zn + 2HCl → ZnCl2 + H2 ↑
1 mol 2 mol 1 mol
0,3 mol → 0,15 mol
Ta có tỷ lệ số mol Zn và HCl là :
0,2/1 < 0,3/2
→ Vậy sau phản ứng Zn dư, HCl hết. Tính theo số mol HCl.
Khối lượng muối ZnCl2 được tạo thành :
nZnCl2 = 0,15 (mol)
mZnCl2 = nZnCl2 x MZnCl2 = 0,15 x 136 = 20,4 (g)
⇒ Chọn đáp án A.
b) Không thể nói trong HCl có các đơn chất hiđro và clo, vì theo định nghĩa hợp chất do từ hai nguyên tố hoá học cấu tạo nên. Do đó chỉ có thể nói trong HCl có các nguyên tố hiđro và clo.
Bài 38.12 trang 54
Thế nào là gốc axit ? Tính hoá trị của các gốc axit tương ứng với các axit sau: HBr, H2S, HNO3, H2SO4, H2SO3, H3PO4, H2CO3.
Bài giải :
Gốc axit là phần còn lại của phân tử axit sau khi tách riêng nguyên tử hiđro trong phân tử axit.
| Axit | Gốc axit | Hóa trị gốc axit |
| HBr | Br | I |
| H2S | S | II |
| HNO3 | NO3 | I |
| H2SO4 | SO4 | II |
| H2SO3 | SO3 | II |
| H3PO4 | PO4 | III |
| H2CO3 | CO3 | II |
Bài 38.13 trang 54
a) Xác định hoá trị của Ca, Na, Fe, Cu, Al trong các hiđroxit sau đây :Ca(OH)2, NaOH, Fe(OH)3, Cu(OH)2, Al(OH)3.
b) Cho 1,35 g nhôm tác dụng với dung dịch chứa 7,3 g HCl. Khối lượng muối tạo thành là
A. 3,3375 g B. 6,675 g. C. 7,775 g. D. 10,775 g.
Bài giải :
a) Hóa trị của Ca, Na, Fe, Cu, Al trong các hiđroxit là :
Ca(OH)2: Ca có hóa trị II
Cu(OH)2 : Cu có hóa trị II
NaOH: Na có hóa trị I
Al(OH)3: Al có hóa trị III
Fe(OH)3: Fe có hóa trị III
b) Số mol Al và HCl là :
nAl = mAl / MAl = 1,35/27 = 0,05 (mol)
nHCl = mHCl / MHCl = 7,3/36,5 = 0,2 (mol)
Phương trình phản ứng :
2Al + 6HCl → 2AlCl3 + 3H2 ↑
2 mol 6 mol
0,05 mol → 0,05 mol
Ta có tỷ lệ số mol Al và HCl là :
0,05/2 < 0,2/6
→ Vậy sau phản ứng Al hết, HCl dư. Tính theo số mol Al.
Khối lượng muối AlCl3 được tạo thành :
nAlCl3 = 0,05(mol)
mAlCl3 = nAlCl3 x MAlCl3 = 0,05 x 133,5 = 6,675 (g)
⇒ Chọn đáp án B.
Bài 38.14 trang 54
Hãy nêu phương pháp nhận biết các khí: cacbon đioxit, oxi, nitơ, hiđro.
Bài giải :
Lấy từng mẫu thử ở mỗi khí. Đưa đầu que đóm có than hồng vào từng mẫu thử.
Mẫu thử nào làm than hồng bùng cháy đó chính là khí oxi.
Khí nào cháy được với ngọn lửa màu xanh, đó là khí hiđro.
Cho các khí còn lại qua nước vôi trong.
Khí nào làm đục nước vôi trong đó là CO2.
Còn lại là khí nitơ không làm đục nước vôi trong.
Phương trình :
Ca(OH)2 + CO2 ⟶ CaCO3 ↓ + H2O
Bài 38.15 trang 54
Cho 60,5 g hỗn hợp gồm hai kim loại kẽm Zn và sắt Fe tác dụng hết với dung dịch axit clohiđric. Thành phần phần trăm khối lượng của sắt trong hỗn hợp là 46,289%. Tính :
a) Khối lượng mỗi kim loại trong hỗn hợp.
b) Thể tích khí H2 (đktc) sinh ra.
c) Khối lượng các muối tạo thành.
Bài giải :
a) Khối lượng kim loại Fe là :
mFe = 50 x 46,289% = 28 (g)
nFe = mFe / MFe = 28/56 = 0,5 (mol)
Khối lượng kim loại Zn là :
mZn = 60,5 – 28 = 32,5 (g)
nZn = mZn / MZn = 32,5/65 = 0,5 (mol)
b) Phương trình phản ứng :
Fe + 2HCl → FeCl2 + H2 ↑ (1)
1 mol 2 mol 1 mol 1 mol
0,5 mol → 0,5 mol → 0,5 mol
Zn + 2HCl → ZnCl2 + H2 ↑ (2)
1 mol 2 mol 1 mol 1 mol
0,5 mol → 0,5 mol → 0,5 mol
Số mol hiđro sinh ra là :
nH2 = nH2(1) + nH2(2) = 0,5 + 0,5 = 1 (mol)
Thể tích khí hiđro sinh ra là :
VH2 = nH2 x 22,4 = 1 x 22,4 = 22,4 (lít)
c) Khối lượng các muối tạo thành là :
mFeCl2 = nFeCl2 x MFeCl2 = 0,5 x 127 = 63,5 (g)
mZnCl2 = nZnCl2 x MZnCl2 = 0,5 x 136 = 68 (g)
Bài 38.16 trang 54
Cho 22,4 g sắt tác dụng với dung dịch loãng có chứa 24,5 g axit H2SO4.
a) Tính thể tích khí H2 thu được ở đktc.
b) Chất nào dư sau phản ứng và dư bao nhiêu gam ?
Bài giải :
Số mol Fe và H2SO4 là :
nFe = mFe / MFe = 22,4/56 = 0,4 (mol)
nH2SO4 = mH2SO4 / MH2SO4 = 24,5/98 = 0,25 (mol)
Phương trình phản ứng :
Fe + H2SO4 → FeSO4 + H2 ↑
1 mol 1 mol 1 mol
0,25 mol ← 0,25 mol → 0,25 mol
Ta có tỷ lệ số mol Fe và H2SO4 là :
0,4/1 > 0,25/1
→ Vậy sau phản ứng H2SO4 hết, Fe dư. Tính theo số mol H2SO4.
a) Thể tích khí hiđro thu được là :
VH2 = nH2 x 22,4 = 0,25 x 22,4 = 5,6 (lít)
b) Sắt dư phản ứng.
Khối lượng sắt phản ứng là :
mFe(pư) = nFe(pư) x MFe = 0,25 x 56 = 14 (g)
Khối lượng sắt dư sau phản ứng là :
mFe(dư) = 22,4 – 14 = 8,4 (g)
Bài 38.17 trang 54
Dẫn 6,72 lít (ở đktc) hỗn hợp hai khí H2 và CO từ từ qua hỗn hợp hai oxit FeO và CuO nung nóng, sau phản ứng thấy khối lượng hỗn hợp giảm m gam.
a) Viết các phương trình hoá học.
b) Tính m.
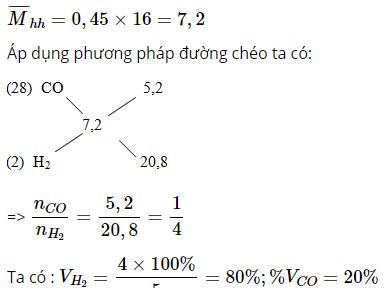
c) Tính phần trăm thể tích các khí, biết tỉ khối hỗn hợp khí so với CH4 bằng 0,45.
Bài giải :
a) Phương trình hóa học :
CuO + H2 Cu + H2O (1)
FeO + H2 Fe + H2O (2)
CO + CuO Cu + CO2 (3)
CO + FeO Fe + CO2 (4)
b) Khối lượng chất rắn giảm đi sau phản ứng do đã mất bớt các nguyên tử oxi trong oxit để tạo thành kim loại
Theo các phương trình hoá học (1), (2), (3), (4) số mol nguyên tử oxi trong oxit mất đi bằng số mol CO hay H2 tham gia.
nhh khí = 6,72/22,4 = 0,3 (mol)
Vậy khối lượng chất rắn giảm đi: m = 0,3 x 16 = 4,8 (g)
c) Gọi số mol H2, CO trong 1 mol hỗn hợp lần lượt là x mol và y mol.
Bài 38.18 trang 54
Cho 3,6 g một oxit sắt vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thu được 6,35 g một muối sắt clorua. Hãy xác định công thức phân tử của oxit sắt.
Bài giải :
Gọi công thức oxit sắt là Fe2Ox
Phương trình phản ứng :
Fe2Ox + 2xHCl → 2FeClx + xH2O (1)
(2.56 + 16x) g 2(56 + 35,5x) g
3,6 g 6,35 g
6,35.(2.56 + 16x) = 3,6. 2(56 + 35,5x) ⇒ x = 2
Công thức oxit sắt là FeO.
Bài 38.19 trang 54
Cho dòng khí H2 dư qua 24g hỗn hợp hai oxit CuO và Fe2O3 nung nóng. Tính khối lượng Fe và Cu thu được sau phản ứng. Biết rằng: mFe2O3 : mCuO = 3 : 1.
Bài giải :
Theo đề bài, ta có tỉ lệ :
mFe2O3 : mCuO = 3 : 1
Bài giải :
a) Khối lượng Fe2O3 là :
mFe2O3 = 24×3 / (3 + 1) = 18 (g)
nFe2O3 = mFe2O3 / MFe2O3 = 18/160 = 0,1125 (mol)
Khối lượng CuO là :
mCuO = 24 – 18 = 6 (g)
nCuO = mCuO / MCuO = 6/80 = 0,075 (mol)
Phương trình phản ứng là :
Fe2O3 + 3H2 2Fe + 3H2O
1 mol 3 mol 2 mol
0,1125 mol → 0,225 mol
CuO + H2 Cu + H2O
1 mol 1 mol 1 mol
0,075 mol → 0,075 mol
Khối lượng Fe và Cu thu được sau phản ứng :
mFe = nFe x MFe = 0,225 x 56 = 12,6 (g)
mCu = nCu x MCu = 0,075 x 64 = 4,8(g)
Bài 38.20 trang 55
Cho 10,4 g oxit của một nguyên tố kim loại hoá trị II tác dụng với dung dịch HCl dư, sau phản ứng tạo thành 15,9 g muối. Xác định nguyên tố kim loại.
Bài giải :
Gọi M là nguyên tố kim loại hoá trị II, công thức phân tử của oxit là MO.
Phương trình phản ứng :
MO + 2HCl → MCl2 + H2O
(M + 16) g (M + 71) g
10,4 g 15,9 g
Theo phương trình hoá học trên, ta có :
15,9 x (M + 16) = 10,4 x (M+71)
→ M = 88 (Sr)
Nguyên tố kim loại là stronti (Sr).
Bài 38.21 trang 55
Cho 0,3 g một kim loại tác dụng hết với nước cho 168 ml khí hiđro (ở đktc). Xác định tên kim loại, biết rằng kim loại có hoá trị tối đa là III.
Bài giải :
Gọi R là kí hiệu, nguyên tử khối của kim loại, có hóa trị n.
Số mol H2 là :
nH2 = 168/22400 = 0,0075 (mol)
Phương trình hóa học :
2R + 2nH2O → 2R(OH)n + nH2
2R g n mol
0,3 g 0,0075 mol
Theo phương trình hóa học, ta có :
2R/0,3 = n/0,0075
⇒ 2R x 0,0075 = 0,3n
⇒ R = 20n
Với : n = 1 → R = 20 không có kim loại nào có nguyên tử khối là 20.
n = 2 → R = 40 (Canxi)
n = 3 → R = 60 ( loại)
Vậy kim loại là Canxi (Ca).
Bài 38.22 trang 55
Cho 5,6 g oxit kim loại tác dụng vừa đủ với dung dịch HCl cho 11,1 g muối clorua của kim loại đó. Xác định tên kim loại. Biết kim loại có hoá trị tối đa là III.
Bài giải :
Gọi R là kí hiệu của nguyên tố kim loại có hóa trị x. Công thức phân tử của oxit kim loại là R2Ox.
Phương trình hóa học :
R2Ox + 2xHCl → 2RClx + xH2O
2MR + 16x 2(MR + 35,5x)
5,6 g 11,1 g
Theo phương trình hóa học, ta có :
(2MR + 16x) / 5,6 = 2(MR + 35,5x) / 11,1
⇒ MR = 20x
Với : x = 1 → R = 20 (loại)
x = 2 → R = 40 (Canxi)
x = 3 → R = 60 (loại)
Vậy kim loại là Canxi (Ca).
Bài 38.23 trang 55
Cho một dòng khí H2 dư qua 4,8 g hỗn hợp CuO và một oxit sắt nung nóng thu được 3,52 g chất rắn. Nếu cho chất rắn đó là hoà tan trong axit HCl thì thu được 0,896 lít H2 (ở đktc). Xác định khối lượng mỗi oxit trong hỗn hợp và công thức phân tử của oxit sắt.
Bài giải :
nH2 = VH2 / 22,4 = 0,896/22,4 = 0,04 (mol)
Gọi a là số mol của CuO
b là số mol của FexOy
Phương trình hóa học :
CuO + H2 Cu + H2O (1)
1 mol 1mol
a mol → a mol
FexOy + yH2 xFe + yH2O (2)
1 mol x mol
b mol → bx mol
Cho hỗn hợp chất rắn vào dung dịch HCl có H2 bay ra, chỉ có Fe tác dụng với HCl.
Fe + 2HCl → FeCl2 + H2 ↑ (3)
1 mol 2 mol 1 mol
bx mol → bx mol
Từ phương trình (3) ta có :
nH2 = nFe = bx (mol) ⇒ bx = 0,04 (mol)
Từ phương trình (2) ta có :
nFe = bx (mol) → nFe = 0,04 (mol)
Khối lượng sắt và đồng là :
mFe = nFe x MFe = 0,04 x 56 = 2,24 (g)
mCu = 3,52 – 2,24 = 1,28 (g)
Số mol Cu là :
nCu = mCu / MCu = 1,28/64 = 0,02 (mol)
nCuO = nCu = 0,02 (mol)
Khối lượng mỗi oxit trong hỗn hợp là :
mCuO = nCuO x MCuO = 0,02 x 80 = 1,6 (g)
mFexOy = 4,8 – 1,6 = 3,2 (g)
mO trong oxit sắt = mFexOy – mFe = 3,2 – 2,24 = 0,96 (g)
Trong công thức FexOy, ta có tỉ lệ :
x : y = 2,24/56 : 0,96/16 = 0,04 : 0,06 = 2 : 3
Vậy công thức phân tử của oxit sắt là Fe2O3.
Bài 38.24 trang 55
Dùng khí H2 khử 31,2 g hỗn hợp CuO và Fe3O4, trong hỗn hợp khối lượng Fe3O4 nhiều hơn khối lượng CuO 15,2 g. Tính khối lượng Cu và Fe thu được.
Bài giải :
Gọi a là khối lượng của CuO ⇒ mFe3O4 = a + 15,2 (g)
Theo đề bài, ta có: a + a +15,2 = 31,2 ⇔ 2a = 16 → a = 8
Vậy khối lượng CuO là 8 (g), khối lượng Fe3O4 là 23,2 (g).
Số mol CuO và Fe3O4 là :
nCuO = mCuO / MCuO = 8/80 = 0,1 (mol)
nFe3O4 = mFe3O4 / MFe3O4 = 23,2/232 = 0,1 (mol)
Phương trình hóa học :
CuO + H2 Cu + H2O (1)
1 mol 1mol
0,1 mol → 0,1 mol
Fe3O4 + 4H2 3Fe + 4H2O (1)
1 mol 3 mol
0,1 mol → 0,3 mol
Khối lượng Cu và Fe là :
mFe = nFe x MFe = 0,3 x 56 = 16,8 (g)
mCu = nCu x MCu = 0,1 x 64 = 6,4 (g)
Đây là nội dung tóm tắt và giải bài tập Chương 5 bài 38: Bài luyện tập 7 trong chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8