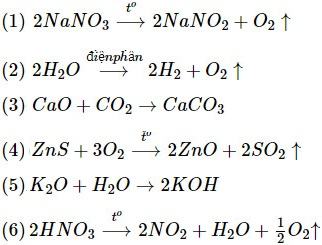Tóm tắt và giải hóa lớp 8 bài 27: Điều chế khí oxi – Phản ứng phân hủy
Tóm tắt và giải hóa lớp 8 bài 27: Điều chế khí oxi – Phản ứng phân hủy
Mục lục
Dưới đây là bài tóm tắt và giải hóa lớp 8 bài 27 mà bạn có thể tham khảo để học hóa tốt hơn !
1. Tóm tắt hóa học lớp 8 bài 27:
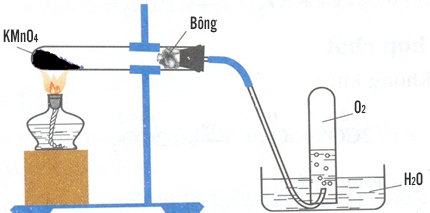
– Trong phòng thí nghiệm, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao.
– Trong công nghiệp, khí oxi được sản xuất từ không khí (chưng cất phân đoạn không khí lỏng) và từ nước (điện phân nước).
– Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
2. Hướng dẫn giải bài tập Hóa học 8 bài 27:
Bài 1 trang 94
Những chất nào trong số những chất sau được dùng để điều chế oxi trong phòng thí nghiệm :
a) Fe3O4 ; b) KClO3 ; c) KMnO4 ; d) CaCO3 ; e) Không khí ; g) H2O.
Bài giải:
Những chất được dùng để điều chế oxi trong phòng thí nghiệm là: b) KClO3 ; c) KMnO4.
Phương trình hóa học:
2KClO3 2KCl + 3O2
2KMnO4 K2MnO4 + MnO2 + O2
Bài 2 trang 94
Sự khác nhau về cách điều chế oxi trong phòng thí nghiệm và trong công nghiệp về nguyên liệu, sản lượng và giá thành ?
Bài giải:
| Phòng thí nghiệm | Công nghiệp | |
| Nguyên liệu | KMnO4 , KClO3 | Không khí và nước |
| Sản lượng | Thể tích nhỏ dùng cho thí nghiệm | Sản lượng lớn dùng cho công nghiệp và y tế. |
| Giá thành | Cao | Thấp |
Bài 3 trang 94
Sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp ? Dẫn ra 2 thí dụ để minh họa.
Bài giải:
| Phản ứng hóa hợp | Phản ứng phân hủy | |
| Chất tham gia | Hai hoặc nhiều chất | Một chất |
| Chất tọa thành | Một chất | Hai hoặc nhiều chất |
| Ví dụ | C + O2 |
CaCO3 |
Bài 4 trang 94
Tính số gam Kali clorat cần thiết để điều chế được :
a) 48 g khí oxi ;
b) 44,8 lít khí oxi (đktc).
Bài giải:
a) Phương trình phản ứng:
2KClO3 2KCl + 3O2
2 mol → 3 mol
2/3 mol ← 1 mol
a) Số mol khí oxi tạo thành:
nO2 = mO2 / MO2 = 48/32 = 1,5 (mol)
Theo phương trình phản ứng, ta có:
nKClO3 = 2/3nO2 = 2/3 x 1,5 = 1 (mol)
Khối lượng kali clorat cần thiết:
mKClO3 = nKClO3 x MKClO3 = 1 x 122,5 = 122,5 (g)
b) Số mol khí oxi tạo thành:
nO2 = VO2 / 22,4 = 44,8/22,4 = 2 (mol)
Theo phương trình phản ứng, ta có:
nKClO3 = 2/3nO2 = 2/3 x 2 = 4/3 (mol)
Khối lượng kali clorat cần thiết:
mKClO3 = nKClO3 x MKClO3 = 4/3 x 122,5 ≈ 163,3 (g)
Bài 5 trang 94
Nung đá vôi CaCO3 được vôi sống CaO và khí cacbonic CO2.
a) Viết phương trình hóa học của phản ứng.
b) Phản ứng nung vôi thuộc loại phản ứng hóa học nào ? Vì sao ?
Bài giải:
a) Phương trình hóa học của phản ứng:
CaCO3 CaO + CO2
b) Phản ứng nung vôi thuộc phản ứng phân hủy. Vì dưới tác động của nhiệt độ, từ một chất (đá vôi) bị phân hủy thành hai chất (vôi sống và khí cacbonic).
Bài 6 trang 94
Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao.
a. Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxit sắt từ ?
b. Tính số gam kali penmanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
Bài giải:
a) Phương trình hóa học của phản ứng:
3Fe + 2O2 Fe3O4
nFe3O4 = mFe3O4 / MFe3O4 = 0,01 (mol)
Số mol sắt và oxi:
nFe = 3nFe3O4 = 0,01 x 3 = 0,03 (mol)
nO2 = 2nFe3O4 = 0,01 x 2 = 0,02 (mol)
Khối lượng sắt và oxi cần dùng là:
mFe = nFe x MFe = 0,03 x 56 = 1,68 (g)
mO2 = nO2 x MO2 = 0,02 x 32 = 0,64 (g)
b) Phương trình hóa học của phản ứng:
2KMnO4 K2MnO4 + MnO2 + O2
Số mol KMnO4 là:
nKMnO4 = 2nO2 = 0,02 x 2 = 0,04 (mol)
Khối lượng KMnO4 cần dùng là:
mKMnO4 = mKMnO4 x MKMnO4 = 0,04 .158 = 6,32 (g)
3. Hướng dẫn giải bài tập Sách bài tập Hóa học 8 bài 27:
Bài 27.1 trang 37
Cho các phản ứng:
Số phản ứng thuộc loại phản ứng phân hủy:
A.2 B. 3 C. 4 D. 5
Bài giải:
Các phản ứng phân hủy: (1), (2), (6)
⇒ Chọn đáp án B.
Bài 27.2 trang 37
Trong bài thực hành thu khí oxi vào ống nghiệm bằng cách đẩy nước và đẩy không khí, có 4 học sinh A, B, C, D đã lắp ráp dụng cụ thí nghiệm như dưới đây. Hãy cho biết học sinh nào đã lắp ráp đúng. Lắp ráp không đúng. Giải thích. Xác định công thức các chất 1, 2, 3 có trong hình vẽ của các thí nghiệm.
Bài giải:
Học sinh A và học sinh C đã lắp ráp đúng.
Học sinh B lắp ráp không đúng vì ống dẫn khí không đi vào ống nghiệm đựng nước do đó oxi bị mất một phần. Còn học sinh D đã lắp ráp không đúng vì ống dẫn khí oxi không đi vào ống nghiệm, dẫn đến sự mất mát khí oxi.
Chất 1 có thể là : KMnO4, KClO3, KNO3,…
Chất 2: Khí O2
Chất 3: H2O
Bài 27.3 trang 38
Trong công nghiệp, oxi được điều chế bằng phương pháp điện phân nước (có pha axit sunfuric), thu được 2 chất khí riêng biệt là oxi và hiđro. Phương trình điện phân nước được biểu diễn như sau :
(lỏng) (khí) (khí)
Điền những số liệu thích hợp vào những chỗ trống trong bảng dưới đây :
| H2O đã dùng | H2 tạo thành | O2 tạo thành |
| a) 2 mol | …………………. mol | …………………. mol |
| b) …………… mol | …………………. g | 16 g |
| c) …………… mol | 10 g | …………………. g |
| d) 45 g | …………………. g | …………………. g |
| e) …………… g | 8,96 lít (đktc) | …………………. lít (đktc) |
| f) 66,6 ml | …………………. g | …………………. lít (đktc) |
(Giả sử phản ứng điện phân nước xảy ra hoàn toàn).
Bài giải:
Cách tính:
a) Theo tỉ lệ phương trình:
nH2O = 2 mol ⇒ nH2 = 2 mol; nO2 = 1×2 / 2 = 1 mol
b) nO2 = 16/32 = 0,5 mol ⇒ nH2O = nH2 = 2nO2 = 2 x 0,5 = 1 mol ⇒ mH2 = 1 x 2 = 2 g
c) nH2 = 10/2 = 5 mol ⇒ nH2O = nH2 = 5mol ; nO2 = 5×1 / 2 = 2,5 mol ⇒mO2 = 32 x 2,5 = 80 g
d) nH2O = 45/18 = 2,5 mol ⇒ nH2 = 2,5 mol ⇒ mH2 = 2,5 x 2 = 5 g
nO2 = 2,5 x 1/2 = 1,25 mol ⇒mO2 = 32. 1,25 = 40 g
e) nH2 = 8,96/22,4 = 0,4 mol ⇒ nH2O = 0,4 mol ⇒ mH2O = = 0,4 .18 = 7,2 g
nO2 = 0,4.1/2 = 0,2 mol ⇒ VO2 = 0,2 . 22,4 = 4,48 lít
f) nH2O = 66,6/18 = 3,7 mol ⇒ nH2 = 3,7 mol ⇒ mH2 = 3,7 .2 = 7,4 g
nO2 = 3,7.1/2 = 1,85 mol ⇒ VO2 = 41,44 lít
| H2O đã dùng | H2 tạo thành | O2 tạo thành |
| a) 2 mol | 2 mol | 1 mol |
| b) 1 mol | 2 g | 16 g |
| c) 5 mol | 10 g | 80 g |
| d) 45 g | 5 g | 40 g |
| e) 7,2 g | 8,96 lít (đktc) | 4,48 lít (đktc) |
| f) 66,6 ml | 7,4 g | 41,44 lít (đktc) |
Bài 27.4 trang 38
a) Trong các chất CuSO4, KClO3, CaCO3, KMnO4, H2O, K2SO4, HgO, những chất nào được dùng để điều chế khí oxi ? Viết phương trình hoá học và nêu điều kiện phản ứng.
b) Tất cả các phản ứng điều chế O2 có thế gọi là phản ứng phân huỷ được không ? Hãy giải thích.
Bài giải:
a) Các chất được dùng để điều chế oxi: KClO3; KMnO4; H2O; HgO
Phương trình hóa học:
2KMnO4 K2MnO4 + MnO2 + O2
2KClO3 2KCl + 3O2
2H2O 2H2 + O2
2HgO 2Hg + O2
b) Tất cả các phản ứng điều chế oxi đều là phản ứng phân huỷ vì từ một chất sinh ra nhiều chất mới (trừ cách điều chế oxi từ không khí).
Bài 27.5 trang 38
Để điều chế một lượng lớn oxi trong công nghiệp người ta dùng những phương pháp nào và bằng những nguyên liệu gì ?
Bài giải:
Trong công nghiệp người ta điều chế oxi thường dùng phương pháp: điện phân H2O hoặc hóa lỏng không khí (ở -196oC) rồi cho bay hơi trở lại, nitơ thoát ra trước rồi đến oxi.
Nguồn nguyên liệu phong phú và rẻ nhất đó là nước và không khí.
Bài 27.6 trang 38
Lấy cùng một lượng KClO3 và KMnO4 để điều chế khí O2. Chất nào cho nhiều khí O2 hơn ?
a) Viết phương trình hoá học và giải thích.
b) Nếu điều chế cùng một thể tích khí oxi thì dùng chất nào kinh tế hơn ? Biết rằng giá KMnO4 là 30.000 đ/kg và KClO3 là 96.000 đ/kg.
Bài giải:
a) Giả sử ta lấy cùng một khối lượng là a g
nKClO3 = mKClO3 / MKClO3 = a/122,5 (mol)
nKMnO4 = mKMnO4 / MKMnO4 = a/158 (mol)
Phương trình hóa học:
2KClO3 2KCl + 3O2
2 mol 2 mol 3 mol
a/122,5 mol ? mol
⇒ nO2(1) = 3a / 2.122,5 = 3a/245 (mol)
2KMnO4 K2MnO4 + MnO2 + O2
2 mol 1 mol 1 mol 1 mol
a/158 mol ? mol
nO2(2) = a / 2.158 = a/316 (mol)
Ta có:
3a/245 > a/316 → nO2(1) > nO2(2)
⇒ Khi nhiệt phân cùng 1 lượng chất, cho nhiều oxi hơn là KClO3
b) Giả sử cần điều chế 3,36 lit O2 tương đương với 0,15 mol O2
2KClO3 2KCl + 3O2
2 mol 2 mol 3 mol
? mol 1,5 mol
nKClO3 = 1,5.2 / 3 = 1 (mol)
mKClO3 = mKClO3 x MKClO3 = 1 x 122,5 = 122,5 (g)
Số tiền mua 122,5g KClO3 để điều chế 1,5 mol O2:
0,1225 x 96000 = 11760 (đồng)
2KMnO4 K2MnO4 + MnO2 + O2
2 mol 1 mol 1 mol 1 mol
? mol 1,5 mol
nKMnO4 = 1,5 x 2 = 3 mol
mKMnO4 = nKMnO4 x mKMnO4 = 3 x 158 = 474 (g)
Số tiền mua 474g KMnO4 để điều chế 1,5 mol O2:
0,474 x 30000 = 14220(đồng)
⇒ Vậy để điều chế cùng 1 thể tích khí O2 thì dùng KClO3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg KClO3 cao hơn nhưng thể tích khí O2 sinh ra nhiều hơn.
Bài 27.7 trang 38
Dùng 3,2 kg khí oxi để đốt cháy khí axetilen. Hỏi với lượng khí oxi như trên, có thể đốt cháy bao nhiêu m3 khí axetilen (đktc) ?
Bài giải:
Số mol khí oxi là:
nO2 = 3,2.1000 / 32 = 100 (mol)
Phương trình hóa học:
2C2H2 + 5O2 4CO2 + 2H2O
2 mol → 5 mol
x mol ← 100 mol
Số mol khí axetilen:
x = 100.2 / 5 = 40 (mol)
Thể tích khí axetilen:
VC2H2 = nC2H2 x 22,4 = 40 x 22,4 = 896 (l)
Số m3 khí axetilen bị đốt cháy là:
896 (l) = 0,896 m3
Bài 27.8 trang 38
Đốt cháy hoàn toàn 5,4 g Al.
a) Tính thể tích oxi cần dùng.
b) Tính số gam KMnO4 cần dùng để điều chế lượng oxi trên.
Bài giải:
a) Phương trình hóa học:
4Al + 3O2 2Al2O3
4 mol 3 mol 2 mol
0,2 mol ? mol
nAl = mAl / MAl = 5,4/27 = 0,2 (mol)
Số mol oxi:
nO2 = 0,2.3 / 4 = 0,15 (mol)
Thể tích khí oxi cần dùng:
VO2 = nO2 x 22,4 = 0,15 x 22,4 = 3,36 (lít)
b) Phương trình hóa học:
2KMnO4 K2MnO4 + MnO2 + O2
2 mol 1 mol 1 mol 1 mol
? mol 1,5 mol
Số mol KMnO4 :
nKMnO4 = 0,15.2 / 1 = 0,3 (mol)
Khối lượng KMnO4 cần dùng để điều chế 0,15 mol oxi là:
mKMnO4 = nKMnO4 x MKMnO4 = 0,3 x 158 = 47,4 (g)
Bài 27.9 trang 39
Người ta điều chế vôi sống (CaO) bằng cách nung đá vôi (CaCO3). Lượng vôi sống thu được từ 1 tấn đá vôi có chứa 10% tạp chất là
A. 0,252 tấn B. 0,378 tấn
C. 0,504 tấn D. 0,606 tấn
(Biết hiệu suất phản ứng là 100%).
Bài giải:
Khối lượng CaCO3 nguyên chất:
mCaCO3 = 1.90 / 100 = 0,9 (tấn)
Phương trình nhiệt phân:
CaCO3 CaO + CO2
100 tấn 56 tấn
0,9 tấn ? tấn
Lượng vôi sống thu được :
mCaO = 0,9.56 / 100 = 0,504 (tấn)
⇒ Chọn đáp án C.
Đây là nội dung tóm tắt và giải bài tập Chương 4 bài 27: Điều chế khí oxi – Phản ứng phân hủy trong chương trình hóa học lớp 8 mà các bạn có thể tham khảo. Mời các bạn cùng tham khảo các bài viết tương tự trong chuyên mục : Hóa học lớp 8